סקירות
תכנון מערכות אלקטרוכימיות לצבירה ולהמרה של אנרגיה לנוכח האתגרים שבהנעה החשמלית ובשימוש באנרגיה מתחדשת
חנה בוזגלו המחלקה לכימיה, אוניברסיטת בר אילן
הדר שקלאר המחלקה לכימיה, אוניברסיטת בר אילן
ואדים דרגל המחלקה לכימיה, אוניברסיטת בר אילן
דניאל שרון המחלקה לכימיה, אוניברסיטת בר אילן
סיוון עוקשי המחלקה לכימיה, אוניברסיטת בר אילן
ברוך זיו המחלקה לכימיה, אוניברסיטת בר אילן ([email protected])
אריה בורנשטיין המחלקה לכימיה, אוניברסיטת בר אילן
אריאל רוזנמן המחלקה לכימיה, אוניברסיטת בר אילן
אורטל יריב המחלקה לכימיה, אוניברסיטת בר אילן
ספיר גלעדי המחלקה לכימיה, אוניברסיטת בר אילן
דורון אורבך המחלקה לכימיה, אוניברסיטת בר אילן ([email protected])

הנעה אלקטרוכימית הפכה להיות אחד האתגרים הטכנולוגיים החשובים של תקופתנו | צילום: CNicola Sznajder
דניאל הירשברג
המחלקה לכימיה, אוניברסיטת בר אילןחנה בוזגלו
המחלקה לכימיה, אוניברסיטת בר אילןהדר שקלאר
המחלקה לכימיה, אוניברסיטת בר אילןואדים דרגל
המחלקה לכימיה, אוניברסיטת בר אילןדניאל שרון
המחלקה לכימיה, אוניברסיטת בר אילןסיוון עוקשי
המחלקה לכימיה, אוניברסיטת בר אילןברוך זיו
המחלקה לכימיה, אוניברסיטת בר אילןאריה בורנשטיין
המחלקה לכימיה, אוניברסיטת בר אילןאריאל רוזנמן
המחלקה לכימיה, אוניברסיטת בר אילןאורטל יריב
המחלקה לכימיה, אוניברסיטת בר אילןספיר גלעדי
המחלקה לכימיה, אוניברסיטת בר אילןדורון אורבך
המחלקה לכימיה, אוניברסיטת בר אילןדניאל הירשברג
המחלקה לכימיה, אוניברסיטת בר אילןחנה בוזגלו
המחלקה לכימיה, אוניברסיטת בר אילןהדר שקלאר
המחלקה לכימיה, אוניברסיטת בר אילןואדים דרגל
המחלקה לכימיה, אוניברסיטת בר אילןדניאל שרון
המחלקה לכימיה, אוניברסיטת בר אילןסיוון עוקשי
המחלקה לכימיה, אוניברסיטת בר אילןברוך זיו
המחלקה לכימיה, אוניברסיטת בר אילןאריה בורנשטיין
המחלקה לכימיה, אוניברסיטת בר אילןאריאל רוזנמן
המחלקה לכימיה, אוניברסיטת בר אילןאורטל יריב
המחלקה לכימיה, אוניברסיטת בר אילןספיר גלעדי
המחלקה לכימיה, אוניברסיטת בר אילןדורון אורבך
המחלקה לכימיה, אוניברסיטת בר אילןבחיים המודרניים קיימת תלות רבה בזמינותם של מקורות כוח חשמליים שיכולים לספק אנרגיה בצורה אמינה ובטוחה לציוד ולמכשור אלקטרוני נייד. בעשרות השנים האחרונות אנו נהנים מהצלחות ניכרות בפיתוח סוללות נטענות עתירות אנרגיה ואמינות, המאפשרות שימוש נרחב בטלפונים ובמחשבים ניידים. בד בבד עם הצרכים האלקטרוניים, מתפתחים בשנים האחרונות אתגרים נוספים בנושאי צבירה והמרה של אנרגיה: השימוש הנרחב בדלקים מתכלים לתחבורה ולייצור חשמל יוצר זיהום אוויר מסוכן במרכזים עירוניים רבים, ומשנה את אקלים כדור הארץ. לפיכך, נדרש מעבר לתחבורה חשמלית, המונעת על-ידי מקורות כוח אלקטרוכימיים, ונדרש שימוש נרחב ככל האפשר באנרגיה מתחדשת (בעיקר שמש ורוח). המאמר שלנו דן באתגרים הללו. אנו מתארים צורכי אנרגיה חשובים, וסוקרים מקורות כוח המתאימים להם. המאמר מתמקד בסוללות, בדגש על סוללות ליתיום נטענות, שמובילות מבחינת צפיפות אנרגיה. אנו מתארים סוללות ראשוניות ושניוניות, סוללות יוני ליתיום החשובות להנעה חשמלית, מערכות במחקר מתקדם כמו ליתיום-גפרית וליתיום חמצן, סוללות לצבירה ולהמרה של אנרגיה מתחדשת כגון סוללות זרימה, סוללות נתרן-גפרית (טמפרטורות גבוהות), וקבלי-על, שהם מערכות נטענות עם צפיפות הספק גבוהה מאוד, הפועלות על-ידי אינטראקציות אלקטרוסטטיות הכוללות ספיחת יונים על פני אלקטרודות בעלות שטח פנים גבוה, ללא תגובות חמצון-חיזור. למאמר מתלווים ששה נספחים חשובים המרחיבים בנושאים הבאים: השוואת ביצועי סוללות, סוגי אלקטרודות לסוללות יוני ליתיום, סוללות ליתיום-גפרית וליתיום-חמצן בעלות צפיפות אנרגיה גבוהה, מערכות לצבירה והמרה של אנרגיה מתחדשת הכוללות סוללות נייחות, סוללות זרימה וקבלי-על.
על קצה המזלג
- הנעת כלי רכב באמצעות סוללות חשמליות, הנטענות ממקורות אנרגיה מתחדשים, תסייע להפחית את זיהום האוויר במרכזי הערים, את דלדול משאבי האנרגיה ואת ההתחממות העולמית.
- צבירת אנרגיה היא אחד החסמים המשמעותיים בשכלול משק האנרגיה. מערכות אלקטרוכימיות ניתן לתכנן כך שיצברו אנרגיה, ויאפשרו את המרתה מאנרגיה כימית לאנרגיה חשמלית.
- מבין המערכות האלקטרוכימיות השונות, סוללות חשמליות הן בעלות פוטנציאל יישומי מבטיח, ובמיוחד סוללת יוני ליתיום בשל צפיפות אנרגיה גבוהה יחסית ויתרונות נוספים.
- כדי שהתחבורה היבשתית תוכל לעבור לעידן ההנעה החשמלית יש צורך בהמשך פיתוח טכנולוגי של מערכות אלקטרוכימיות, שייתן מענה לאתגרים המורכבים של היישום בשטח.
המערכת
הלכה למעשה
הקדמה
האדם המודרני "מכור" לקצב חיים מהיר, שמאפשר גישה מהירה וקלה לכל מאגרי המידע ורשתות התקשורת למיניהן. הוא תלוי יותר ויותר במכשירים אלקטרוניים ניידים, הצורכים אנרגיה רבה. אתגרי האנרגיה כוללים ייצור אנרגיה, המרתה ואגירתה. מדובר בנושא נרחב ביותר. למשל, ניתן לייצר אנרגיה על-ידי תגובות גרעיניות וכימיות, מפעלים הידרו-אלקטריים, קליטת חום ממעבה האדמה, קליטת קרינת השמש וקליטת אנרגיה מכנית מרוח (כולל קליטת אנרגיה מגלי הים). ניתן לצבור אנרגיה על-ידי אגירת חום, דחיסת אוויר ותגובות כימיות ייעודיות. במאמר הזה בחרנו לעסוק בצבירה ובהמרה של אנרגיה, כנושא כללי. אחת מהאפשרויות החשובות ביותר הקיימות להמרת אנרגיה קשורה למערכות אלקטרוכימיות. תגובות אלקטרוכימיות מאפשרות הפיכה ישירה של אנרגיה כימית לאנרגיה ולעבודה חשמלית. עקב חשיבותן הרבה בחיי היום-יום בחרנו להתרכז במאמר זה במערכות אלקטרוכימיות בלבד. המרת אנרגיה על-ידי מערכות אלקטרוכימיות כוללת: תאים פוטו-וולטאיים, שיכולים להפוך ישירות קרינה לכוח אלקטרו-מניע (EMF); תאי דלק וסוללות, שממירים אנרגיה כימית לאנרגיה חשמלית; קבלי-על, שהופכים אינטראקציות אלקטרוסטטיות לכוח אלקטרו-מניע. כל אחת מהמערכות הללו מצדיקה דיונים עמוקים ורחבי היקף. בחרנו להתמקד הפעם בסוללות חשמליות ובקבלי-על. את האתגרים העומדים בפני מפתחי הטכנולוגיות האלקטרוכימיות לצבירה ולאגירה של אנרגיה אפשר לחלק לשלושה כיוונים עיקריים על פי השימושים:
- מקורות כוח למכשירים ניידים, למערכות אלקטרו-אופטיות, לציוד מחשבים, לתקשורת, לכלי עבודה ולצעצועים.
- מקורות כוח להנעה חשמלית: תחבורה חשמלית (כלי רכב חשמליים) ותעופה חשמלית (כלי טיס לא מאוישים).
- מקורות כוח לאיזון עומס של רשת החשמל, לצבירה ולהמרה של אנרגיה מתחדשת.
באשר לשימוש הראשון, אנו רואים התקדמות מרשימה בשנים האחרונות. סוללות יוני ליתיום נטענות, בעלות צפיפות אנרגיה גבוהה, מאפשרות כיום שימוש נרחב בציוד אלקטרוני נייד ומתוחכם.
אתגרי ההנעה החשמלית
באשר לשימוש השני, הנעה אלקטרוכימית הפכה להיות אחד האתגרים הטכנולוגיים החשובים של תקופתנו. יש החלטות אסטרטגיות עולמיות בכל הארצות המובילות מבחינה כלכלית בעולם להתנתק משימוש בדלק לתחבורה. הסיבות לכך כוללות מחיר משתנה, בעיות גאופוליטיות הקשורות למדינות העשירות בנפט, בעיות זיהום אוויר בערים הגדולות ובעיות אקלים גלובליות הקשורות לפליטת גזי חממה ולהתחממות כדור הארץ. כל יצרניות הרכב קיבלו לא מכבר החלטות לייצר ולשווק כלי רכב חשמליים. ניתן לטעון ללא היסוס שהתחבורה היבשתית נכנסת לעידן ההנעה החשמלית. גם אם מדובר בתהליך אִטי עדיין, הרי שהכיוון ודאי חיובי.
חשוב לציין שהיעילות של מנועי בעירה פנימית (כלומר היחס בין האנרגיה המנוצלת לזו הטמונה בדלק) בהפיכת אנרגיית בעירת דלק לאנרגיית הנעה היא נמוכה, מתחת ל-25%. לעומת זאת, להנעה אלקטרוכימית יש יעילות גבוהה בהרבה. אפילו אם ממשיכים לייצר חשמל על-ידי שרפת דלקים מתכלים, יעילות תחנות כוח לייצור חשמל יכולה להגיע ל-50% ויותר. כלומר, תחנות חשמל מודרניות מצליחות לנצל לצורך ייצור אנרגיה חשמלית מעל למחצית מהאנרגיה הכימית הטמונה בדלק. בארגון נכון של קווי מתח גבוה ותמסורות לכלי רכב חשמליים, ניתן להגיע לניצול אנרגיה כולל של כ-40% במעבר בין שרפת דלק לייצור חשמל, להנעה יבשתית באמצעות כלי רכב חשמליים.
בעינינו, תחבורה יבשתית בעלת הנעה חשמלית היא פתרון מוצלח בהרבה מגישות המעודדות ייצור דלקים מפסולת, מאצות או מצמחים. פתרונות מסוג תחליפי דלק מנציחות את בעיות זיהום האוויר. איור 1 מראה את יתרון ההנעה החשמלית.
איור 1
השוואה בין היעילות של מנועי בעירה פנימית לזו של כלי רכב חשמליים
מנועי בעירה פנימית פועלים לפי עיקרון של שרפת דלקים ממקורות נפט או מחזור פסולת, או על ידי הפקת אתנול, מתנול ופחמימנים ממקור צמחי (ביודיזל). הם מציגים יעילות כוללת הנמוכה מ-25% ופליטת כמות רבה של חומרים מזהמים. לעומתם, כלי רכב חשמליים מונעים בחשמל המגיע מרשת החשמל, ויעילותם היא מעל ל-40% ללא פליטה של חומרים מזהמים בנקודת השימוש. גם אם מייצרים חשמל על-ידי שרפת פחם, הזיהום הוא מחוץ לאזורים מיושבים. שימוש באנרגיית השמש מגדיל את היתרון עוד יותר.
כדי לאפשר להנעה החשמלית כושר תחרות מלא עם הנעה במנועי בעירה פנימית יש לפתח מקורות כוח אלקטרוכימיים בעלי צפיפות אנרגיה גבוהה. מְכל בנזין ברכב קונבנציונלי מאפשר נסיעה של מאות רבות של קילומטרים בין תדלוק לתדלוק. להנעה חשמלית באמצעות תאי דלק יש סיכוי להתחרות עם הנעה קונבנציונלית מבחינת טווחי נסיעה. בתא דלק גורמים באופן אלקטרוכימי לתגובה בין דלק (מימן או תרכובות אורגניות פשוטות כמו מתנול, אתנול או אתילן גליקול) וחמצן מהאוויר, וכך הופכים אנרגיה כימית של בעירה לאנרגיה חשמלית באופן ישיר. קיים ספק אם יש בידינו טכנולוגיות בשלות בתחום הזה, ולכן לטווח הנראה לעין, מקורות הכוח האלקטרוכימיים הרלוונטיים להנעה חשמלית הם סוללות נטענות בעלות צפיפות אנרגיה גבוהה.
הסוללות הנטענות הרלוונטיות להנעה חשמלית כיום הן סוללות יוני ליתיום (ראו להלן). לסוללות יוני ליתיום צפיפות אנרגיה גבוהה יחסית לסוללות אחרות, אולם היא עדיין נמוכה מכדי לאפשר נסיעות ארוכות ללא טעינה. במכונית נוסעים רגילה ניתן להקצות נפח של עד 200 ליטר לסוללה חשמלית במשקל של עד 400 ק"ג. סוללה לרכב חשמלי (אלקטרוכימי) חייבת לכלול מאות תאים של יוני ליתיום בודדים המחוברים בטור ובמקביל כדי לאפשר מתח גבוה (מעל ל-200V), וזרמים גבוהים (כמה עשרות אמפר). כמו כן, הסוללה חייבת לכלול גם מערכת קירור ומערכות שליטה חשמליות. איור 2 ממחיש את מורכבותה של סוללה שלמה לרכב חשמלי מלא. צפיפות האנרגיה של תא יוני ליתיום בודד בטכנולוגיה מתאימה מבחינת ביצועים ובטיחות לשימוש ברכב חשמלי יכולה להגיע לכ-150 ואט-שעה לק"ג. בפועל, סוללה חשמלית מלאה לרכב חשמלי על כל מערכותיה יכולה להגיע לצפיפות אנרגיה של כ-100 ואט-שעה לק"ג בלבד. סוללה השוקלת 400 ק"ג יכולה להכיל אנרגיה של 40,000 ואט-שעה. כמות כזו של אנרגיה מאפשרת נסיעה של כ-200 ק"מ מטעינה לטעינה בלבד. הגדלת משקל הסוללה ונפחה כדי לאפשר נסיעות ארוכות יותר עלולה לגרום בעיות בטיחות.
איור 2
רכיבי סוללה לכלי רכב חשמליים
כל סוללה חייבת לכלול גם מערכת שליטה אלקטרונית (א), המווסתת את ניצול האנרגיה מהסוללות ומאפשרת ויסות טמפרטורה במארז (ב); המארז עצמו מורכב מתאים בודדים המחוברים בטור ובמקביל (ג).
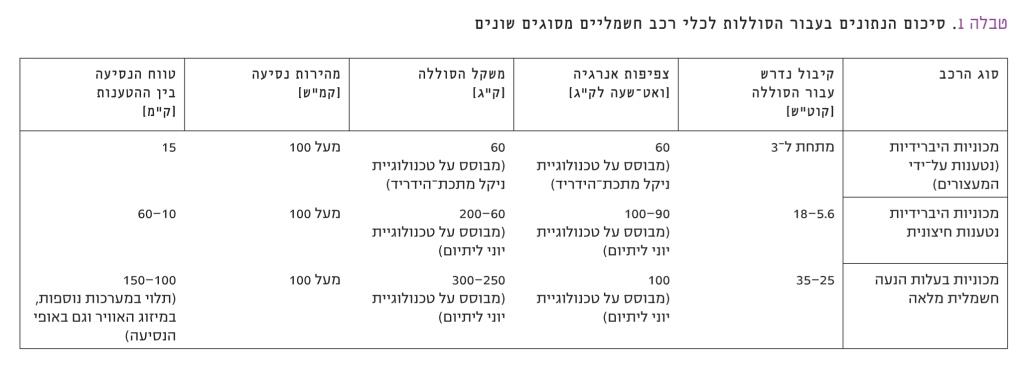
ברחבי העולם נעשה מאמץ להגדיל את צפיפות האנרגיה של סוללות ליתיום נטענות על-ידי פיתוח חומרים חדשים. על מגבלות הטווח של מכוניות חשמליות עם סוללות בטכנולוגיות הקיימות כיום ניתן להתגבר על-ידי הפעלת מכוניות היברידיות, שהן מכוניות בעלות הנעה כפולה – חשמלית ומנוע בעירה פנימית. כמו כן, מפותחות מכוניות בעלות הנעה חשמלית בלבד, שכוללות מחולל חשמלי שמונע בדלק, וטוען את הסוללה במהלך נסיעות ממושכות. כל הפתרונות ההיברידיים הללו מאפשרים חיסכון ניכר בדלק, שהרי חלק גדול מהנסיעות מתנהל באנרגיה המוזנת מרשת החשמל. טבלה 1 מסכמת את נושא פיתוח כלי הרכב החשמליים ומגבלותיהם.
יש מקום להזכיר את המיזם הישראלי פינרג'י, שבמסגרתו מפותחות מכוניות חשמליות הכוללות סוללות יוני ליתיום נטענות וסוללות אלומיניום אוויר. לסוללות אלומיניום אוויר צפיפות אנרגיה גבוהה ביותר. מדובר בסוללות חד-פעמיות, שניתן לשחזר את תוצרי התגובה שלהן. מהבוצה המתקבלת לאחר פריקת הסוללה ניתן לייצר אלומיניום בתהליך אלקטרוליזה.
ניתן לומר לסיכום, שאתגר כלי הרכב החשמליים כגורם שחרור מתלות בנפט מתממש והולך בשנים האחרונות. התכונות החשובות ביותר הנדרשות ממקורות כוח להנעה חשמלית הן צפיפות אנרגיה גבוהה, פריקה עצמית זניחה, מספר מחזורים גבוה ורמת בטיחות מצוינת. הקהיליה המדעית-טכנולוגית בכל העולם שוקדת על דרכים להגיע למטרות הללו.
שימושים נייחים למערכות צבירה והמרה של אנרגיה
האתגר השלישי הגדול הקשור לפיתוח מערכות אגירה אלקטרוכימיות הוא הדרישה לאגירה רחבת היקף של אנרגיה חשמלית, כתמיכה בייצור חשמל בכלל ועל-ידי מקורות אנרגיה מתחדשת בפרט. גם ללא שימוש באנרגיית שמש או רוח, יש דרישה למערכות אגירת אנרגיה חשמלית, שכן צריכת החשמל מעצם טבעה משתנה במהלך היממה. ניתן לחסוך בעלות ייצור החשמל אם תחנות הכוח יעבדו בהספק קבוע, כך שעודפי חשמל בזמן של צריכה נמוכה ייאגרו במערכות אלקטרוכימיות וישוחררו לרשת בזמני צריכה גבוהים.
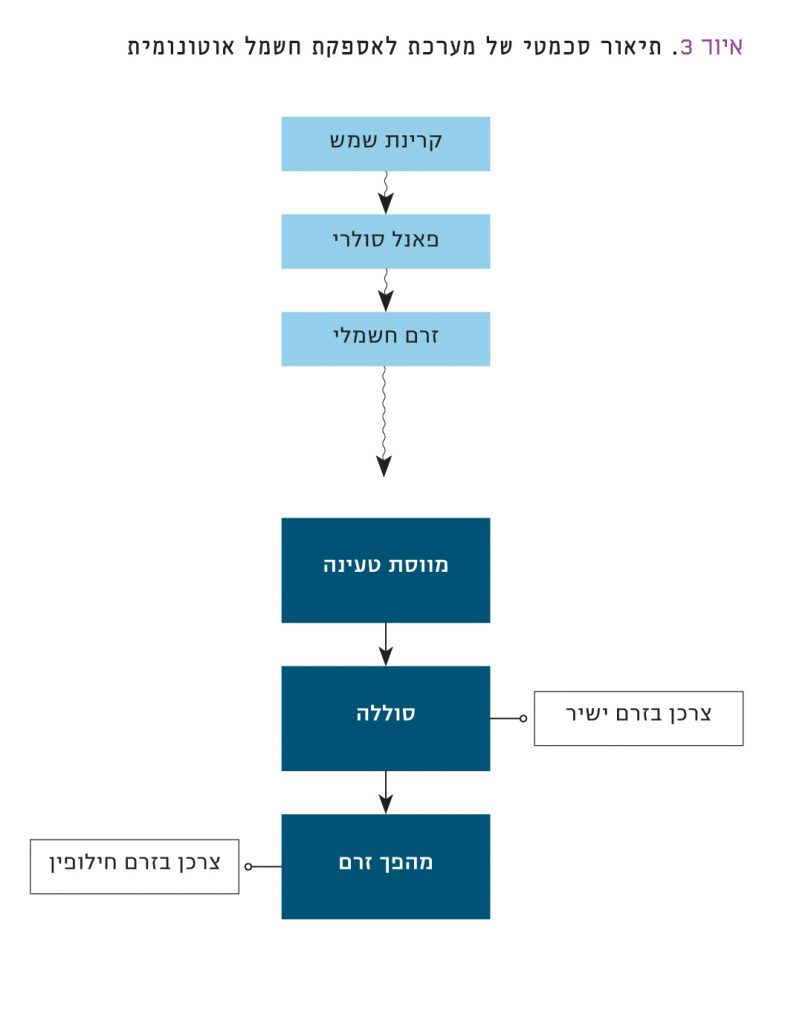
מקורות אנרגיה מתחדשים, כשמש ורוח, הם בעלי הספק לא קבוע. קרינת השמש רלוונטית אך ורק בשעות היום, ומשתנה במהלכן. כמו כן, מזג האוויר משפיע אף הוא על קרינת השמש (עננות, אבק או משקעים). טורבינות רוח הן מעצם טבען מקור אנרגיה לא קבוע. לכן, שמש ורוח יכולות להיות מקור אנרגיה משמעותי אך ורק אם קיימות מערכות אגירה אמינות לצד טורבינות הרוח או הפאנלים הסולָריים, המאפשרות צבירה רחבת היקף של אנרגיה חשמלית ושחרור לרשת לפי הצרכים. בניגוד להנעה חשמלית המצריכה ממקורות הכוח האלקטרוכימיים צפיפות אנרגיה גבוהה ביותר, הרי שהדרישות ממערכות אלקטרוכימיות לאגירת אנרגיה מתחדשת שונות לחלוטין. לצפיפות האנרגיה חשיבות נמוכה. לעומת זאת, ליציבות, למספר מחזורים גבוה, לשימוש ביסודות נפוצים וליכולת לבנות סוללות גדולות, זולות ואמינות – חשיבות רבה. איור 3 מתאר את אתגר אספקת החשמל האוטונומית על-ידי פאנלים סולָריים שצמודות להם סוללות חשמליות אמינות. אלה מאפשרים יחד אספקת חשמל רציפה, ללא תלות ברשת חשמל חיצונית. במקומות רבים בעולם שרשתות החשמל לא מפותחות בהם דיָן או שלא ניתן למתוח אותן עקב תנאים גאוגרפיים, יש חשיבות רבה למערכות לאספקת חשמל אוטונומית.
איך עובדת סוללה חשמלית?
כפי שהוזכר לעיל בקצרה, סוללה חשמלית היא מערכת שהופכת אנרגיה כימית לאנרגיה חשמלית. סוללות קיימות כבר תקופה ארוכה. אלסנדרו וולטה האיטלקי תכנן ובנה סוללות אלקטרוכימיות כבר בשנת 1800. הסוללה של וולטה הייתה מורכבת מלוחות של אבץ (האלקטרודה השלילית) ונחושת (האלקטרודה החיובית), שהופרדו בחתיכות לבד טבולות במי מלח. הסוללה של וולטה התבססה על התא הגלווני של לואיג'י גלווני, שכבר ב-1780 גילה כיצד חיבור בין שתי מתכות יכול ליצור זרם במעגל חיצוני.
את התאים האלקטרוכימיים השונים המשמשים כסוללות, ניתן לחלק לשני סוגים על פי עקרונות פעולתם:
- תאים ראשוניים: תאים המכילים כמות קבועה של מגיבים שעוברים במהלך פריקת התא הראשונה תגובה לא הפיכה, כך שלא ניתן לטעון אותם שנית.
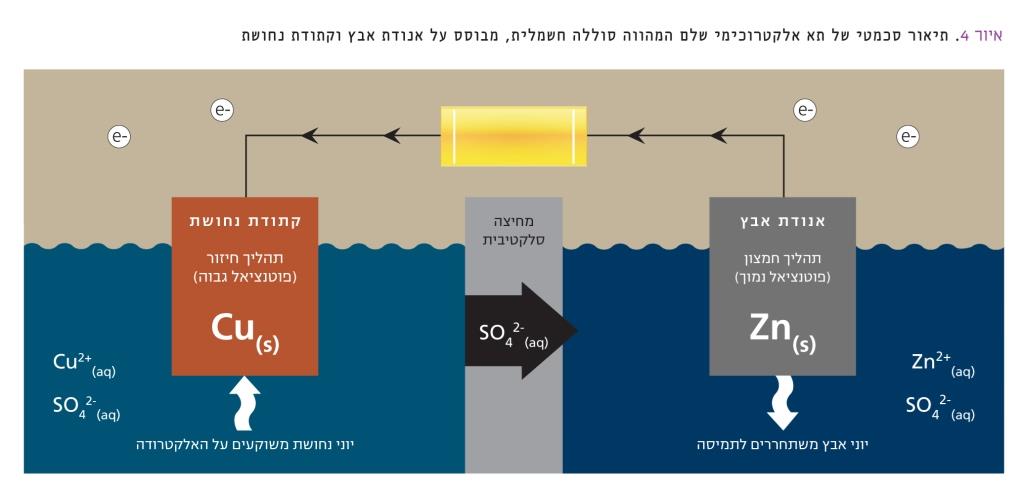
- תאים שניוניים: תאים שמתרחשות בהם תגובות הפיכות. לאחר תהליך הפריקה של התא ניתן להחזיר את המערכת למצבה ההתחלתי על-ידי טעינה חשמלית, כך שניתן יהיה לנצל שוב את האנרגיה הכימית שלה בתהליך פריקה, וחוזר חלילה. איור 4 מתאר באופן סכמטי כיצד עובדת סוללה חשמלית.
לצורך הדגמה, בחרנו במערכת פשוטה: אנודת אבץ (הקוטב השלילי) וקתודת נחושת (הקוטב החיובי) בתמיסות יוניהן. שני חצאי התאים מופרדים במחיצה סלקטיבית. הזרם החשמלי (אלקטרונים) זורם במעגל החיצוני, וזרם יונים עובר באותו זמן דרך המחיצה הסלקטיבית, וכך המערכת נשארת מאוזנת מבחינה חשמלית.
סוללות מנצלות תגובות כימיות מבוקרות של חמצון וחיזור, שהתהליך הרצוי מתרחש בהן בצורה אלקטרוכימית על-ידי העברת מטען מבוקרת. הסלקטיביות של התגובות מצריכה בחירה זהירה של המרכיבים הכימיים, כולל ההחלטה על המבנה והמורפולוגיה הרצויים. לדוגמה, שימוש בחומרים ננומטריים בסוללות חשמליות לא תמיד עדיף על שימוש בחלקיקים בעלי גודל מיקרומטרי, ולעתים אף מזיק עקב פעילות יתר המביאה לתגובות לוואי. בסוללות שנמכרות כיום בשוק משתמשים בחומרים בעלי חלקיקים מסדר גודל של מיקרונים אחדים [5, 6].
כל סוללה חשמלית מבטאת תגובה מלאה של חמצון-חיזור. תכונות החומרים באות לידי ביטוי בנתונים התרמודינמיים של תגובות החמצון-חיזור. מתחי הסוללות הם תוצאה של התגובות הללו, ומשקפים את הנתונים. תגובות חמצון-חיזור כימיות משחררות אנרגיה רבה בצורת חום (למשל תגובת בעירה). בסוללה חשמלית מופרדות תגובות החמצון והחיזור, וחיבורן דרך מעגל חיצוני יוצר זרם חשמלי הניתן לניצול מידי.
הנה דוגמה לתגובה כזו המוסברת לפרטים [3]: תגובה בין ליתיום ותחמוצת מנגן Li+MnO2→LiMnO2 היא תגובה אנרגטית שיכולה לשחרר חום רב. בסוללות ליתיום התגובות מופרדות כדלהלן:
תגובת האנודה (חמצון):
תגובת הקתודה (חיזור) :
בסוללות מסחריות הליתיום מודבק בדרך כלל לרדיד נחושת, ואילו אבקת תחמוצת המנגן מודבקת לרדיד אלומיניום. האלקטרודות מושרות בתמיסת מלחי ליתיום עם ממסים אורגניים מתאימים, ומופרדות בספוג פולימרי דק למניעת קצר. המערכת סגורה הרמטית ומאפשרת מגעים חשמליים בין האלקטרודות. במהלך פריקה זורמים אלקטרונים מרדיד הנחושת (תגובת האנודה, חמצון) לרדיד האלומיניום (תגובת הקתודה, חיזור), מתכת הליתיום מתמוססת ומתכלה, ואבקת תחמוצת המנגן הופכת לאבקת התרכובת LiMnO2. מתחי העבודה של הסוללות יכולים להיות קבועים או משתנים במהלך פעולתן, על פי מהות החומרים הפעילים. הפרמטרים החשובים בסוללות הם מתח (וולט, V), קיבול (אמפר-שעה, Ah), הספק (ואט, W) ואנרגיה (ואט-שעה, Wh). הקיבול הוא מכפלת הזרם שהסוללה יכולה לתת במשך הזמן שהסוללה יכולה לעבוד. ההספק הוא מכפלת המתח בזרם (V•A=W). חשובים ביותר הם הפרמטרים הסגוליים, אנרגיה והספק ליחידות משקל ונפח (Wh/kg, Wh/L, W/kg, W/L). יש לציין שצפיפות אנרגיה וצפיפות הספק באים אחד על חשבון השני. התלות האופיינית של צפיפות אנרגיה בצפיפות הספק של סוללות מתוארת בדיאגרמת רגוני המובאת בנספח 1.
לסוללות נטענות חשובים הפרמטרים הבאים:
- יעילות תהליך המרת האנרגיה: יעילות תהליך המרת האנרגיה בסוללה מוגדר כיחס שבין כמות המטען שהשתחררה בשעת תהליך הפריקה לבין כמות המטען הדרושה כדי לטעון את הסוללה שנית. ערך זה נמוך ממאה אחוזים אם תהליך הטעינה כולל תגובות לוואי הצורכות מטען בצורה לא הפיכה. נוסף על אופיים של מרכיבי התא השונים משפיעים גם צפיפות הזרם, הטמפרטורה וגיל הסוללה.
- מספר מחזורים יעילים: אחד הפרמטרים החשובים שסוללה נטענת נבחנת בהם הוא מספר מחזורי הטעינה-פריקה היעילים שהיא עוברת ללא איבוד קיבול משמעותי. סוף חיי סוללה נטענת מוגדר כמצב שבו הקיבול יורד אל מתחת ל-80% מערכו הראשוני.
- קצבי העבודה המתבטאים בעוצמת זרמי פריקה האפשריים ובזמן הנדרש לטעינה יעילה.
סוגי סוללות
יש לציין שתחום הסוללות הוא תחום נרחב מאוד. עשרות אלפי מאמרים ומאות ספרים נכתבו ופורסמו על אודות סוללות חשמליות וההיבטים המדעיים שלהן. סוגי הסוללות מחולקים לקטגוריות רבות ושונות, וכל קטגוריה מחולקת לתת-קטגוריות נוספות, שחלק מהן יפורטו כאן: סוג החומרים המעורבים, מנגנון הפעולה האלקטרוכימי ויכולת הסחרור, כלומר הרצת מחזורי פריקה-טעינה (סוללות ראשוניות או נטענות).
ישנן מספר מערכות חשובות של סוללות ראשוניות, להלן שתי דוגמאות (נבחרו שכן הן מייצגות סוללות בשימוש נרחב ונפוץ).
המערכת הראשונה היא סוללת Zn – MnO2. במערכת זו מנצלים אנודת אבץ וקתודת מנגן אוקסיד בתגובות שדלהלן [4]:
התגובה בצד האנודי :
התגובה בצד הקתודי :
התגובה הכוללת:
התמיסה האלקטרוליטית במערכת זו היא מימית בסיסית (H2O + KOH). יוני ההידרוקסיד משתתפים בפועל בתגובה, אך אינם מתכלים. מתח העבודה של סוללות מסוג זה הוא 1.5 וולט [5].
סוג נוסף של סוללות ראשוניות המנצלות אבץ מתכתי כאנודה הן סוללות כסף-אבץ. בסוללה זו אנודת האבץ עוברת תהליך התמוססות כמו בסוללות Zn-MnO2. קתודת תחמוצת הכסף עוברת תהליך של חיזור לכסף מתכתי [9].
סוללות חשמליות חשובות נוספות הן סוללות נטענות מסוג ניקל-הידריד. האנודות בסוללות אלה מורכבות מסגסוגות מתכתיות היוצרות הידרידים על-ידי תגובה עם מים. הסגסוגות מורכבות מתערובת מתכות כמו לנתן, ניקל וקובלט. בטעינה נוצרת תרכובת הידריד והידרוקסיד –M+ H2O + e– <-> MH + OH. תרכובת ההידריד היא האנודה הפעילה: משחררת אלקטרונים ומימן שמתחבר ליוני הידרוקסיד ויוצר מים. אנודה זו יכולה לעבור אלפי מחזורים של טעינה-פריקה ללא ירידה משמעותית בקיבול. הקתודה עשוייה מניקל אוקסי-הידריד (NiOOH) העובר חיזור לניקל הידרוקסיד (Ni(OH)2). האנרגיה הסגולית של תאים מסוג זה יכולה להגיע ל-100 ואט-שעה לק"ג. חיסרון משמעותי בסוללות ניקל מתכת-הידריד הוא שלסוללה קצב פריקה עצמית גבוה ומרכיביה יקרים. סוללות ליתיום ראשוניות משתמשות בליתיום מתכתי כאנודה, לדוגמה סוללות ליתיום-תיוניל כלוריד. לסוללות אלה צפיפות אנרגיה גבוהה מאוד, 480 ואט-שעה לק"ג [2]. הממס, תיוניל-כלוריד, משמש גם כחומר הפעיל של הקתודה [5], התגובה היא כדלהלן: 4Li + 2SOCI2 -> 4LiCl + S + SO2. מתח העבודה של תאים מסוג זה הוא 3.5V. היתרון הבולט של המערכת הזו היא בכך שהתא מסוגל לעבוד בטמפרטורות נמוכות, (55-) מעלות צלזיוס, ועדיין לשמור על כ-50% מהקיבול שלו.
סוללות ראשוניות מעניינות נוספות הן סוללות תרמיות. מדובר בסוללות שניתן לאכסן לאורך זמן ללא כל שינוי, והן פועלות רק בטמפרטורות גבוהות למשך זמן קצר, תוך שחרור הספקים גבוהים. סוללות אלה משמשות בעיקר למכשירים צבאיים. ישנן סוללות תרמיות המבוססות על אנודת ליתיום מתכתית, תחמוצת מתכת מעבר (למשל תחמוצת נחושת) ומערכת אלקטרוליטית מוצקה, כמו תערובת מלחי ליתיום. בעת הצורך, הסוללה מחוממת כך שמלחי הליתיום ניתכים, ומשמשים כמערכת אלקטרוליטית נוזלית המאפשרת פעולה של סוללת ליתיום ראשונית מהירה ביותר.
הסוללות שתוארו עד כה הן מערכות סגורות, משמע, בייצור הסוללה מכניסים את כל רכיבי הסוללה (אלקטרודות ותמיסה אלקטרוליטית) לאריזה קבועה, ואוטמים את המערכת כדי למנוע דליפות. ישנן סוללות פתוחות – סוללות זרימה, המתוארות בנספח 1ו. מערכות פתוחות נוספות הן תאי דלק.
תאי דלק הם סוללות שבהן דלק (מימן, מתנול, אתנול) מגיב עם חמצן בתגובת חמצון-חיזור אלקטרוכימית מבוקרת, במקום תגובת בעירה ישירה. תא דלק נבדל מסוללה רגילה בכך שהמערכת פתוחה, ויש הזרמה קבועה של חומרים שמגיבים אלקטרוכימית, לדוגמה: גז מימן המוזרם בצד האנודי, מגיב עם חמצן המוזרם בצד הקתודי, ומתחמצן ליצירת מים תוך יצירת כוח אלקטרו-מניע. תאי דלק הם נושא מרתק בפני עצמו אך אינם נידונים כאן.
סוללות יוני ליתיום
סוללות יוני ליתיום יכולות להיחשב מערכות המרת האנרגיה החשובות ביותר בחיינו כיום. לסוללות יוני ליתיום צפיפות אנרגיה גבוהה, והן בטיחותיות לשימוש. הודות לאנרגיה הסגולית הגבוהה שלהן והאפשרות להשיג מספר רב של מחזורי טעינה ופריקה, הפכו סוללות יוני הליתיום הנטענות למקורות הכוח העיקריים במכשירים ניידים חשמליים. מתכת הליתיום היא ללא ספק החומר האנודי האידאלי – מתכת קלה ופעילה המסוגלת לשחרר אלקטרונים בקיבול עצום (3800 אמפר-שעה לק"ג). אולם לא ניתן להשתמש בה כאנודה בסוללות נטענות בגלל שתי בעיות יסודיות:
- ליתיום היא אחת המתכות הפעילות בטבע. שימוש בה בסוללה נטענת גורם בעיית בטיחות חמורה, שכן הפעילות המחזורית מייצרת ליתיום בעל שטח פנים גבוה שהוא חומר דליק.
- ליתיום, כמתכת פעילה, מגיב עם מרכיבים אחרים בסוללה, ומתכלה בתגובות שיתוך. לכן, מספר מחזורי הפריקה והטעינה שניתן לקבל עם סוללות ליתיום מתכתי הוא מוגבל ביותר.
במקום ליתיום ניתן להשתמש בתרכובות ליתיום פעילות, כגון תרכובות פחמן-ליתיום שהן חומרים מחזרים – מוסרי אלקטרונים. בשימוש בהם מוותרים על קיבול גבוה, אך מרוויחים אפשרות לפעילות בתנאי בטיחות טובים וקבלת מספר רב של מחזורי פריקה וטעינה. נספח 2 מציג את עקרון הפעולה של סוללות אלה.
החומר האנודי הקלָסי הוא גרפיט. ניתן להגיע לתרכובת גרפיט-ליתיום מסוג LiC6, שמתח העבודה שלה קרוב לזה של ליתיום מתכתי. עבור חומרים קתודיים משתמשים לרוב בתחמוצות של מתכות מעבר, למשל LixCoO2, LixMnO2, LixMn1/3Ni13Co1/3ו-LixNi0.8Co0.15Al0.05. גם תרכובות מסוג LixFePO4 עובדות היטב כחומרים קתודיים (1>X>).
סוללות יוני ליתיום מורכבות כסוללות פרוקות, ורק הקתודות מכילות יוני ליתיום. בצורה כזו, ניתן לייצר מערכות בטוחות ויציבות לשינוע ולאחסון. בטעינה של הסוללה (על-ידי הפעלת מקור כוח חשמלי) גורמים לחמצון של מתכות המעבר בחומרים הקתודיים תוך כדי יציאה של יוני ליתיום. יוני הליתיום עוברים דרך התמיסה האלקטרוליטית ונכנסים לתוך אנודת הגרפיט העוברת תהליך חיזור (נטענת ביוני ליתיום ובאלקטרונים). בתהליך הפריקה (שימוש בסוללה) מחברים מכשיר חשמלי למעגל החיצוני, זרם אלקטרונים זורם באופן ספונטני מהאנודה לקתודה, ובתוך התמיסה זורמים יוני ליתיום מהאנודה אל הקתודה. מתכות המעבר מקבלות אלקטרונים ועוברות חיזור למצב ההתחלתי שלהן. למערכות אלה ניתן הכינוי סוללות "כיסא הנדנדה" (rocking chair batteries) [1, 7], שכן יוני הליתיום נעים הלוך ושוב בין האלקטרודות, והתגובות המתרחשות הפיכות ויכולות לחזור על עצמן מספר רב של פעמים. הסוללה המסחרית הנמכרת ביותר כיום היא סוללת יוני ליתיום הכוללת קתודת LiCoO2 ואנודת גרפיט.
התמיסות המתאימות ביותר כוללות ממסים הנקראים אלקיל קרבונטים (ROCO2R), והמלח LiPF6. נוסחאות המבנה של הממסים האופייניים מובאות בנספח 2.
הנספח המצורף למאמר זה כולל פירוט באשר לאנודות ולקתודות לסוללות ליתיום נטענות (נספחים 3 ו-4). הנספח מתאר סוללות מתקדמות מסוג ליתיום גפרית וליתיום חמצן (נספח 5). כמו כן, מתאר נספח 6 מערכות מתאימות לצבירה ולהמרה של אנרגיה מתחדשת, הכוללות סוללות עופרת חומצה, סוללות יוני ליתיום ייחודיות, סוללות נתרן-גפרית, סוללות זרימה וקבלי-על.


- הנעת כלי רכב באמצעות סוללות חשמליות, הנטענות ממקורות אנרגיה מתחדשים, תסייע להפחית את זיהום האוויר במרכזי הערים, את דלדול משאבי האנרגיה ואת ההתחממות העולמית.
- צבירת אנרגיה היא אחד החסמים המשמעותיים בשכלול משק האנרגיה. מערכות אלקטרוכימיות ניתן לתכנן כך שיצברו אנרגיה, ויאפשרו את המרתה מאנרגיה כימית לאנרגיה חשמלית.
- מבין המערכות האלקטרוכימיות השונות, סוללות חשמליות הן בעלות פוטנציאל יישומי מבטיח, ובמיוחד סוללת יוני ליתיום בשל צפיפות אנרגיה גבוהה יחסית ויתרונות נוספים.
- כדי שהתחבורה היבשתית תוכל לעבור לעידן ההנעה החשמלית יש צורך בהמשך פיתוח טכנולוגי של מערכות אלקטרוכימיות, שייתן מענה לאתגרים המורכבים של היישום בשטח.
המערכת
נספחים
נספח 1-6
להורדהמקורות
- Aurbach D. 2000. Review of selected electrode–solution interactions which determine the performance of Li and Li ion batteries. Journal of Power Sources 89: 206-218.
- Levy SC and Bro P. 1994. Battery hazards and accident prevention. New York: Plenum press.
- Linden D and Reddy TB (Eds). 2001. Handbook of batteries. New York: McGraw Hill Professional.
- Marsal PA, Kordesch K, and Urry LF. 1960. Dry Cell. US Patent 2960558 A.
- Sclar H, Kovacheva D, Zhecheva E, et al. 2009. On the performance of LiNi1 / 3Mn1 / 3Co1 / 3O2 nanoparticles as a cathode material for lithium-ion batteries. Journal of The Electrochemical Society 156: A938-A948.
- Talyosef Y, Markovsky B, Lavi R, et al. 2007. Comparing the behavior of nano- and microsized particles of LiMn5Ni0.5O4 spinel as cathode materials for Li-ion batteries. Journal of the Electrochemical Society 154: A682-A691.
- Tarascon JM and Armand M. 2001. Review article issues and challenges facing rechargeable lithium batteries. Nature 414: 359-367.
- Thackeray MM, Wolverton C, and Isaacs ED. 2012. Electrical energy storage for transportation – Approaching the limits of, and going beyond, lithium-ion batteries. Energy and Environmental Science 5: 7854-7863.
- Winter M and Brodd RJ. 2004. What are batteries, fuel cells, and supercapacitors. Chemical Reviews 104(10): 4245-4269.







 מהדורה מודפסת
מהדורה מודפסת












