חזית המחקר
לקראת הרחקה זולה ובטוחה של מתכות משפכים
יעל דובובסקי הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראל
אורי להב הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראל ([email protected])

הימצאות מתכות בתשטיפי מכרות נחשבת לבעיה סביבתית משמעותית ברחבי העולם. בישראל אין כרייה פעילה, וחידוש כריית הנחושת בתמנע צפוי להיעשות בתהליך שלא ייווצרו בו שפכים תעשייתיים | צילום: יצחק גורן
מאת
סיון קלס
הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראל; המחלקה להנדסה כימית ולכימייה יישומית, אוניברסיטת טורונטו, קנדהיעל דובובסקי
הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראלאורי להב
הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראלמאת
סיון קלס
הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראל; המחלקה להנדסה כימית ולכימייה יישומית, אוניברסיטת טורונטו, קנדהיעל דובובסקי
הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראלאורי להב
הפקולטה להנדסה אזרחית וסביבתית, הטכניון – מכון טכנולוגי לישראלהמאמר סוקר את הבעיה העולמית בהתמודות עם שפכים, שנוצרים בתעשיות הכרייה וגימור המתכות, ומכילים מתכות, ודן בטכנולוגיות הקיימות לטיפול בשפכים אלו ובבוצות שהם יוצרים. בהמשך, מתאר המאמר טכנולוגיה בשם "תהליך הפֶריט" (The ferrite process) כחלופה לשיטות הנהוגות כיום. בבחינת התהליך בתנאי מעבדה נמצא כי ריכוזי שש מתכות שונות (אבץ – Zn, קובלט – Co, ניקל – Ni, אלומיניום – Al, קדמיום – Cd, כרום – Cr) בקולחים שעברו טיפול בתהליך הפֶריט היו נמוכים בהרבה מהתקן. תוצר התהליך, פֶריט, הוא בעל תכולת מים נמוכה מאוד ביחס למשקעים אחרים הנוצרים בתהליכים שגרתיים, יכול לשמש כחומר גלם במגוון תהליכים, ויציב כימית בתנאי הסביבה. המגבלה העיקרית לתהליך היא הצורך בכמות גבוהה יחסית של ברזל ביחס למתכת הרעילה בשפכים. יחס זה כומת עבור שש מתכות שונות בטמפרטורות שיקוע גבוהות (80–100 מעלות צלזיוס) ונמוכות (20–30 מעלות). הגורמים האחראיים למגבלה זו מתוארים, כמו גם השלכותיה על הכדאיות הכלכלית של התהליך.
על קצה המזלג
המאמר דן בסוגיה של הרחקת מתכות משפכים תעשייתיים וכן בטיפול בתוצרי לוואי, כגון בוצות הנחשבות פסולת מסוכנת. לנוכח רעילותן של המתכות, מותרים ריכוזים נמוכים ביותר להזרמתן כשפכים. הקנסות על זיהום הסביבה מצד אחד, והערך הכלכלי של המתכות שבשפכים מצד שני, הם תמריצים משמעותיים לפיתוח טכניקות למִחזור ולהשבה של המתכות (כמוצר או כחומר גלם בתעשייה) כבר בתהליכי ההפקה והעיבוד השונים. סוגיה זו רלוונטית במיוחד לנוכח הדרישות הצפויות ממפעלי תעשייה במסגרת המנגנון, שמקים המשרד להגנת הסביבה, לטיפול סביבתי משולב במפעלים ובמתקנים תעשייתיים גדולים ובעלי רמת סיכון גבוהה. המנגנון יפעל לפי עקרונות ההנחיה המחייבת המעודכנת של האיחוד האירופי, IPPC (Integrated Pollution Prevention and Control, Directive 2010/75/EU), באמצעות קביעת הוראות ליישום "הטכניקה המיטבית הזמינה" (BAT – Best Available Technology).
במאמר מוצגת טכנולוגיה של "תהליך הפֶריט" (ferrite) המתבססת על שיקוע של מגנטיט – תחמוצת ברזל טבעית בעלת משקל סגולי גבוה ותכונות מגנטיות. תהליך הפֶריט הוא תהליך פשוט יחסית, המאפשר טיפול במַרבית השפכים והבאתם לריכוזי מתכות מתחת לרמה הנדרשת בתקנות, תוך יצירת מוצקים יציבים ביותר, בעלי נפח קָטָן, שיש להם פוטנציאל לשימוש מסחרי. תהליך הפֶריט יכול להיות חלופה אטרקטיבית לטיפול בשפכים המכילים מגוון מתכות, בְּעלוּת דומה לזו של תהליכי הקצה הנהוגים כיום.
מערכת אקולוגיה וסביבה
לאור זאת, ייתכן שיתאים להגדרת "הטכניקה המיטבית הזמינה" דלעיל. כמו כן, המאמר מעלה אפשרות להשבה קלה וזולה יחסית של מתכות יקרות הספוחות על גבי הפריטים, כגון קדמיום, כרום, נחושת, כספית ועופרת.
הלכה למעשה
מבוא
שפכים המכילים מתכות – בעיה עולמית
המתכות הן קרוב לוודאי הרעלנים העתיקים ביותר הידועים לאדם, ומיוחסות להן השפעות בריאותיות שליליות רבות וקיצוניות על מגוון אברים ומערכות בגוף, כגון מערכת החיסון, מערכת העצבים והמערכת הגנטית [5]. רעילות זו מתבטאת בריכוזי הסף הנמוכים של מרבית המתכות הכבדות במי שתייה בישראל ובעולם, שנעים בין 0.001 ל-0.05 מ"ג לליטר [3]. עבור שפכי תעשייה המוזרמים למערכת הביוב, הריכוזים המותרים נעים בדרך כלל בין 0.1 ל-0.5 מ"ג לליטר [4]. שפכים עשירים במתכות רעילות נוצרים בשלבי כריית המתכות, עיבודן וגימורן. עפרות המתכות מורכבות לרוב ממינרלים המכילים סולפידים (בדרך כלל פיריט, FeS2). לאחר הכרייה נחשפים מינרלים אלה לחמצן ולמים, והסולפיד מתחמצן תוך שחרור סולפט וחומצה (SO42- ויוני +H) למים. החמצת המים מאיצה בתורה שחרור של מתכות נוספות שבמסלע. "שפכים" או תשטיפים אלו מכונים Acid Mine Drainage – AMD, ערך ההגבה (pH) שלהם יכול להגיע לערכים נמוכים מ-2.0 והם יכולים להכיל עשרות מ"ג לליטר של מתכות רעילות מסוגים שונים. תשטיפי מכרות נחשבים לבעיה סביבתית גדולה בעולם. בישראל הבעיה כמעט שאינה קיימת, מאחר שלמעט מכרה הנחושת בתמנע (הצפוי לחדש את פעילותו ב-2013 לאחר כ-20 שנות השבתה), אין בה מכרות להפקת מתכות. שפכים המכילים מתכות נוצרים, כאמור, גם בתעשיית גימור המתכות, אם כתוצאה מתהליכים פיזיקו-כימיים שונים (למשל תהליכי ניקוי פני שטח המתכת בעזרת חומצה, בסיס, או חומרים היוצרים תרכובות מומסות עם המתכת [קומפלקסים]), או כתוצאה מזיהום תמיסות התהליך השונות. המגוון הגדול של התהליכים בתעשייה מביא למגוון רחב של הרכבי שפכים שכוללים לעתים חומרים רעילים נוספים כגון ציאניד. בישראל ישנם כיום 92 בתי עסק ומפעלים ביטחוניים העוסקים בטיפול פני שטח ובציפוי מתכות (ערן סגל, מידע בע"פ).
התהליך הנפוץ ביותר להרחקת המתכות משפכים תעשייתיים הוא העלאת ערך ההגבה בעזרת סיד (CaO, Ca(OH)2) ו/או גיר (CaCO3), ושיקוע (precipitation) המתכות כאוקסי-הידרוקסידים ו/או הידרוקסידים. תהליך זה הוא הזול ביותר (הסיד והגיר הם מינרלים זולים מאוד), ומביא להרחקה מספקת בדרך כלל של המתכות מהמים. אולם הבוצה הנוצרת בדרך זו מכילה 95% מים לכל הפחות ואינה יציבה בתנאים סביבתיים, דהיינו המתכות צפויות להשתחרר מהפאזה המוצקה לפאזה המימית כאשר ערך ההגבה יורד לערכים אופייניים לסביבה. הטיפול בבוצות אלה, שמוגדרות במקרים רבים כפסולת רעילה, הוא סוגיה בפני עצמה. בשפכי מכרות נהוג להוסיף עודף של בסיס לבוצה ולהשאירה בברֵכות שיקוע ענקיות, לערבב אותה בברֵכות של פסולת מסוגים אחרים (tailing ponds) או להחדיר אותה למכרות נטושים [7]. בישראל נחשבות בוצות אלו פסולת מסוכנת, ומחייבות העברה לאתר רמת חובב לטיפול מתאים. שיקוע של המתכות כסולפידים או כקרבונטים מבוצע אף הוא לעתים, אבל הבעייתיות של הבוצות הנוצרות דומה (התחמצנות של סולפידים ובעיית הפרדה של המוצקים מהמים). הנפח הגדול של הבוצה מגדיל מאוד את עלויות הטיפול, במיוחד אם נדרשת הובלה. מחיר ההטמנה באתר מוסדר הוא יקר (בקנדה, למשל, היו המחירים בשנת 2005 50-90 דולר לטון באתר הטמנה רגיל ללא ייצוב והובלה, וכ-160 דולר לטון באתר פסולת מסוכנת [20]). אי לכך, במקרים רבים יש מספר שלבי טיפול הכוללים אוורור, הוספת מפתיתים (פלוקולנטים), סחרור, יישון (aging) ואף מכבשי סרט, שיכולים להגדיל את ריכוז המוצקים ("הסמכה") עד 50% (בדרך כלל לא יותר מ-30%). בקנדה, לדוגמה, מיוצרים מדי שנה לפחות 6.7 מיליון טון של בוצות בתעשיית הכרייה בלבד [20]. בעשרות השנים האחרונות נעשו מאמצים גדולים להפחתת כמויות הבוצות מתעשיית גימור המתכות (מִחזור בשלבי התהליך השונים, הסמכה), ולמרות זאת עדיין נוצרות מדי שנה כמויות גדולות ביותר שלהן. במדינות האיחוד האירופי מיוצרים מדי שנה כ-150 אלף טון בוצות [14]. כמויות המתכות שהוזרמו לשפד"ן בשנת 1995 הוערכו בכ-87 טון אבץ, 27 טון נחושת, 20 טון כרום, 6 טון ניקל, 3 טון עופרת ו-0.5 טון קדמיום [1]. יצוין כי מנתוני המשרד להגנת הסביבה עולה כי עד 2003 חלה ירידה של כסדר גודל בריכוזי חלק מהמתכות בבוצת השפד"ן [2].
טכנולוגיות חלופיות
טכנולוגיות חלופיות לטיפול בשפכים המכילים מתכות, פותחו במטרה להשיב (recover) את המתכות, או לשלב את הבוצות במוצר הניתן לשימוש. ההשבה של מתכות משפכים היא תחום שנחקר זה עשרות שנים, ובמקרים רבים, כמו בשפכי מכרות מסוימים, לא נמצאה חלופה כלכלית לשיקוע ההידרוקסידי [20]. הבעייתיות שבהשבת המתכות נעוצה בריכוזן הנמוך בשפכים (0.1–1,000 מ"ג לליטר) לעומת ריכוזן הגבוה בתמיסות התהליך, שמגיע לעשרות גרמים לליטר. הבעיה מחמירה כאשר השפכים מכילים מספר מתכות בו-זמנית ומזהמים נוספים (חומרים אורגניים, קומפלקסים, חומרים פעילי שטח וכו'). עם זאת, הקנסות האפשריים על זיהום הסביבה מצד אחד, והערך הכלכלי של המתכות שבשפכים מצד שני, הם תמריצים משמעותיים למִחזור המתכות כבר בתהליכי ההפקה והעיבוד השונים, תוך צמצום משמעותי של כמות השפכים. במקרים רבים, ההשקעה הכספית במִחזור כזה יכולה להחזיר את עצמה [1]. קיים מגוון רחב של טכנולוגיות המאפשרות השבה של מתכות בדרגות ניקיון שונות, ועלותן נגזרת בדרך כלל מאיכות השפכים. טכנולוגיות אלה כוללות מחליפי יונים, ממברנות, פחם פעיל ושיקוע אלקטרוכימי (תוך שימוש באלקטרודות בעלות שטח פנים גדול) [1]. במקרים רבים משולבות מספר טכנולוגיות להשגת הניקיון הדרוש. לצורך טיפול בשפכי מכרות הוצעו גם שיקוע כימי עם מספר אניונים בטור (OH–, S2-, F–, CO3-2) תוך ניצול קבועי שיווי המשקל השונים להפרדה בין המתכות. טכנולוגיות אחרות שהוצעו כוללות ספיחה לתחמוצות (ברזל בדרך כלל) או ספיחה סלקטיבית (באמצעות מולקולות ייעודיות המקובעות על גבי מצע קֵרָמי), ללא צורך בהוספת בסיס ותוך מִחזור המצע [6]. טכנולוגיות שנועדו לטפל בבוצות כוללות המסה סלקטיבית לצורך הפרדת המתכות, ייצוב הבוצות על-ידי מיצוק (שילוב של מלט, אפר פחם, סיליקטים ופוספָטים) ואף השבה של המתכות על-ידי שרֵפת הבוצה בכבשנים [20]. עם זאת, כאמור, שיקולי העלות גורמים לכך שהשימוש בסיד או בגיר ממשיך להיות הפתרון הנפוץ ביותר בתעשיית הכרייה, ופתרון קצה לשפכי מפעלים רבים בתעשיית גימור המתכות.
החלופה המוצעת
כחלופה לטכנולוגיות הקיימות נבחנה על-ידינו טכנולוגיה לא מוכרת יחסית בשם "תהליך הפֶריט" (The ferrite process). בשנות ה-70 הוצע תהליך זה ביפן להרחקת מתכות משפכי מעבדה [10] בהתבסס על שיקוע (precipitation) של המינרל מגנטיט (Fe3O4). המגנטיט הוא תחמוצת ברזל המצויה בטבע, שמשקלה הסגולי גבוה (מעל 5), ויש לה תכונות מגנטיות (הביטוי "אבן שואבת" מיוחס למינרל זה, ששימש גם להכנת המצפנים הראשונים). המבנה המולקולרי שלו מכיל שני אטומי ברזל תלת-ערכי (+Fe3) ואטום ברזל דו-ערכי אחד (+Fe2), הממוקמים בשני סוגי מרווחים הנוצרים בין שכבות החמצן (איור 1א). גמישות זו מאפשרת למספר רב של מתכות להחליף את אטומי הברזל ולהתקבע במבנה הגביש. המינרל הנוצר כתוצאה מהחלפה זו מכונה "מגנטיט מוחלף" (substituted magnetite) או "פֶריט" (ferrite) (איור 1ב), ונוסחתו הכימית היא MexFe3-xO4, כאשר Me מייצג מתכת שונה מברזל.
איור 1
מבנה מולקולרי (א) שכבות צפופות של אטומי חמצן במבנה המגנטיט יוצרות מרווחים בעלי צורה אוקטהדרלית וטטרהדרלית, שבחלק מהם ממוקמים אטומי הברזל [11]. (ב) תמונת מיקרוסקופ אלקטרונים של פריט-אבץ שנוצר במעבדה בטמפרטורה של 30°C. מתוך [11] Klas
תהליך הפֶריט נראה מבטיח מאחר שהוא גם ידידותי לסביבה וגם עשוי להיות זול בהרבה מהטכנולוגיות הקיימות, מהסיבות הבאות:
- למינרל יציבות כימית גבוהה בתנאים סביבתיים מגוונים, ולכן אין צורך בהטמנה יקרה באתר פסולת מסוכנת.
- עקב תכונותיו הפיזיקליות השונות של הפֶריט יש לו שימושים רבים במגוון תעשיות (חשמל, כימייה, סביבה).
- המגנטיט הוא עפרת ברזל חשובה, וקיימת אפשרות להשיב את המתכות שבפֶריט באמצעות תהליך הפקת הברזל (smelting).
- קל מאוד להפריד את הפֶריט מהמים (הבוצה מכילה מעל 70% מוצקים לאחר שיקוע גרביטציוני בלבד). אי לכך, נפחי הבוצה קטנים, עלויות השינוע יורדות, ומעל ל-98% מהמים מטוהרים.
- הכימיקלים הדרושים להפקת הפֶריט הם בסיס וברזל שעלותם נמוכה.
- ריכוזי המתכות בקולחים נמוכים ביותר – הרבה מתחת לתקן.
החיסרון העיקרי של תהליך הפֶריט המקורי נעוץ בטמפרטורות הגבוהות יחסית, לפחות 65 מעלות, הדרושות כדי לקבל פאזה טהורה שלו. עם זאת, ב-15 השנים האחרונות נעשו מספר מחקרים שהראו כי ניתן לשקע בקלות יחסית פאזה טהורה של מגנטיט (Fe3O4) בטמפרטורת החדר על-ידי שימוש בריכוז גבוה של גרעיני נוקלאציה (שהם למעשה, חלקיקי מגנטיט בגודל ממוצע של כ-10 מיקרומטר) שמקטינים את אנרגיית השפעול (activation) הדרושה ליצירת המבנה גבישי של המגנטיט. אולם מדיווחים שונים בספרות [15, 17] נראה כי התהליך עבד היטב בנוכחות ברזל בלבד או בריכוזים נמוכים מאוד של מתכות אחרות. נוכחות משמעותית של מתכות אחרות בתמיסה הראשונית הגדילה את היווצרותן של פאזות מוצקות לא רצויות [17], הקטינה את יעילות הקיבוע של המתכת [15], והגדילה את שחרורה מהתוצר הסופי לתמיסה חומצית [18]. הגורמים לכך ודרכים לצמצום התופעה לא היו ברורים.
מטרות המחקר
המטרה העיקרית של המחקר הייתה לכמת את המידה המֵרבית שניתן לקבע בה מתכות שונות במבנה הפֶריט ("מידת ההטמעה") בעת שיקוע בטמפרטורת הסביבה. מדד זה קובע את כמות הברזל שצריך להוסיף ממקור חיצוני, ובהתאם גם את כמות הבסיס הנוספת (הברזל מתנהג כחומצה). שאלה זו נבחנה גם עבור פֶריטים ששוקעו בטמפרטורות גבוהות (80–100 מעלות), מאחר שגם בתנאים אלו התגלתה חוסר הסכמה בספרות עבור חלק מהמתכות, בעיקר ניקל וכרום [13]. הסיבות שבגללן ניתן להטמיע מתכות מסוימות במידה גדולה יותר מאחרות, נבחנו אף הן. נוסף על כך, נבדקה ההשפעה של קיבוע המתכות בפֶריט על היציבות הכימית שלו.
שיטות
בשלב ראשון הוכנו פֶריטים בטמפרטורות גבוהות (90 מעלות) [19], ביחסים שונים של ברזל למתכת אחת אחרת (קובלט, ניקל, אבץ, קדמיום, כרום ואלומיניום) המצויה בדרך כלל בשפכים, וזאת במטרה לקבוע את מידת ההטמעה המֵרבית בתנאים מיטביים. המשקעים שנוצרו נשטפו בחומצה (pH = 2.0) למשך שעה להרחקת מתכות ספוחות. למשקעים השטופים בוצעו שלוש אנליזות משלימות במטרה לקבוע את מידת ההטמעה: אנליזה כימית (לאחר המסה מלאה בחומצה מרוכזת), בדיקה קריסטלוגרפית (פיזור [diffraction] קרני X, לזיהוי מבנה הגבישים ומאפייניהם) ומבחן התמוססות (לאפיון התפלגות המתכות בעומק המוצק). היציבות הכימית (היחסית) של הפֶריטים הוערכה על סמך קצב ההתמוססות של הברזל מהמשקע (השטוף) בחומצה חזקה (12.5% HCl).
בשלב שני הוכנו מספר דוגמאות מייצגות של פֶריטים ב-20 מעלות וב-30 מעלות בשני הליכים הקיימים בספרות [15, 17], והתוצרים טופלו ונבדקו באופן דומה.
תוצאות ודיון
הכמות המֵרבית של מתכת שאפשר לקבע בפֶריט
מתוך האנליזות השונות וניתוח הספרות הקיימת נקבעה מידת ההטמעה המֵרבית בטמפרטורות גבוהות כדלקמן (במונחים של X בנוסחה MexFe3-xO4): 1.0, 1.0, 0.78, 0.49, 0.35, 0.0 עבור אבץ, קובלט, ניקל, אלומיניום, קדמיום וכרום בהתאמה.
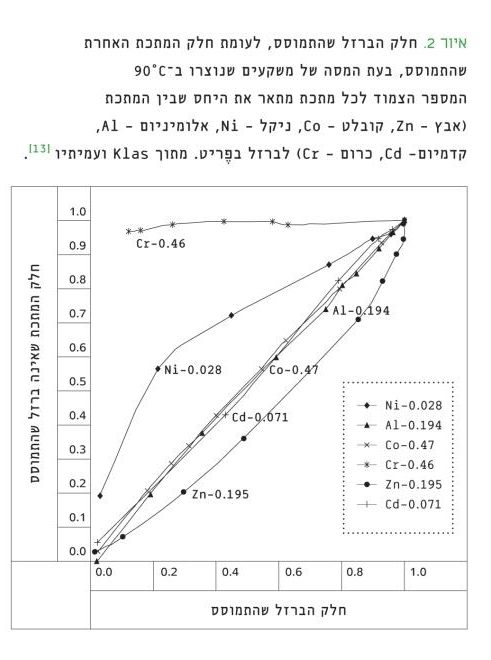
התברר כי אנליזה כימית ובדיקה קריסטלוגרפית בלבד עשויות להוביל למסקנות שגויות בעת קביעת מידת ההטמעה. זאת מכיוון שאף על פי שהמוצקים נשטפו למשך שעה בחומצה, חלק מהם (פֶריטים עם ניקל וכרום), עדיין הכילו פאזות מוצקות בעלות מבנה אמורפי (דהיינו, אינן פֶריט), שלא ניתן לזהותן בבדיקה הקריסטלוגרפית. נוכחות הפאזות האמורפיות התבררה רק מתוצאות ההמסה ההדרגתית של המשקעים השטופים (איור 2). כרום, למשל, השתחרר כולו מיָדית לתמיסה, בעוד שברזל השתחרר בהדרגה במשך מספר שעות. תוצאות אלו חוזקו על-ידי אנליזת (XPS X-ray Photoelectron Spectroscopy) המאפשרת כימות היסודות השונים על פני השטח של המוצק.
איור 2
חלק הברזל שהתמוסס, לעומת חלק המתכת האחרת שהתמוסס, בעת המסה של משקעים שנוצרו ב-90°C
המספר הצמוד לכל מתכת מתאר את היחס שבין המתכת (אבץ – Zn, קובלט – Co, ניקל – Ni, אלומיניום – Al, קדמיום- Cd, כרום – Cr) לברזל בֶפריט. מתוך Klas ועמיתיו [13].
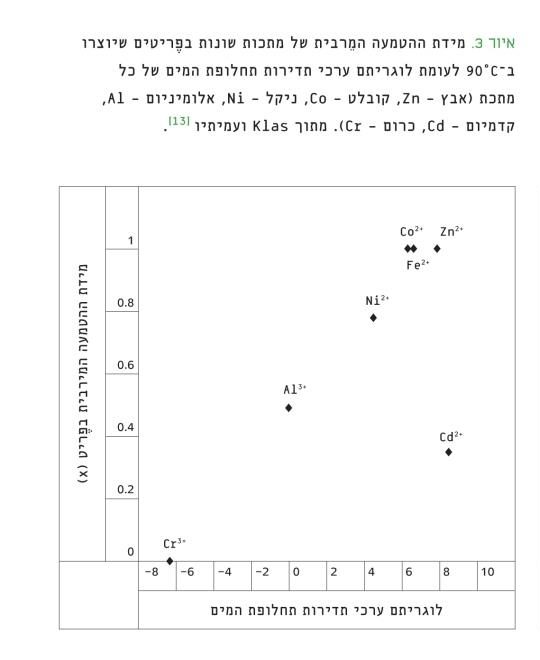
מספר רב של הסברים הוצעו בספרות למידת ההטמעה השונה של המתכות שונות בעת שיקוע הפֶריט [13], אולם אף אחד מההסברים הללו לא תאם את התוצאות שלעיל. המחקר הנוכחי הצביע על קשר אפשרי בין מידת ההטמעה המֵרבית לבין תדירות (קצב) תחלופת המים שבין שכבות המים העוטפות את אטום המתכת המומס (איור 3). משתנה זה נחשב כמדד לנטייה של מתכות להשתתף בתגובות כימיות בסביבה מימית [8] מאחר שכדי שהמתכת תוכל ליצור קשר כימי עם אטום או עם מולקולה אחרת, לפחות מולקולת מים אחת צריכה לעזוב את שכבת המִיוּם הפנימית [16]. הקשר שבין קצב תחלופת המים למידת ההטמעה מצביע על כך שבעיקר שיקולים קינטיים קובעים את מידת ההטמעה השונה שבין המתכות. התגבשות הפֶריטים מתרחשת במספר שלבים: בתחילה נוצר מוצק אמורפי הנקרא "חומר ביניים" ומאופיין ביציבות תרמודינמית פחותה מזו של הפֶריט. בשלב הבא מתמוסס חומר הביניים בזמן שגביש הפֶריט גדל, בתהליך הנקרא "גיבוש מחדש" (recrystalization). ככל שהמתכת מגיבה לאט יותר (כי קצב תחלופת המים שלה נמוך), היא נוטה יותר להישאר ב"מצב הביניים" האמורפי, בעוד שהברזל ממשיך להתגבש ליצירת פֶריט.
איור 3
מידת ההטמעה המֵרבית של מתכות שונות בפריטים שיוצרו ב-90°C לעומת לוגריתם ערכי תדירות תחלופת המים של כל מתכת (אבץ – Zn, קובלט – Co, ניקל – Ni, אלומיניום – Al, קדמיום – Cd, כרום – Cr). מתוך Klas ועמיתיו [13].
ההסבר להתנהגות החריגה בהקשר זה של יון הקדמיום נקשר להפרש הגדול שבין הרדיוס שלו לבין רדיוס הברזל בתוך מבנה הגביש (46%–28 הבדל), לעומת הרדיוסים הקרובים יחסית (עד כ-18% הבדל) עבור שאר המתכות שנבדקו. ההבדל הגדול ברדיוסים עשוי לגרום למאמצים בתוך הגביש, שמונעים את היווצרותו מעל רמה מסוימת של הטמעה. דבר זה יכול להסביר את העובדה שקצב ההתמוססות של גבישי פֶריט הקדמיום היה מהיר בהרבה משל שאר הפֶריטים (איור 4).
איור 4
קצבי התמוססות של ברזל מפריטים שהוכנו במספר שיטות כתלות בכמות המתכת האחרת במשקע
המספר הצמוד לכל מתכת מציין את טמפרטורת הסינתזה. קווים נמתחו רק בין דוגמאות שהוכנו ב-90°C. מתוך Klas ועמיתיו [12].
מידת ההטמעה המֵרבית של ארבע המתכות הדו-ערכיות (אבץ, קובלט, ניקל וקדמיום) בפֶריטים שסונתזו ב-20–30 מעלות הייתה נמוכה בכ-50%–25 מזו שהושגה ב-90 מעלות. עם זאת, נתגלה שנוכחות גבוהה מהתאוריה של ברזל דו-ערכי (על חשבון ברזל תלת-ערכי), הגדילה את מידת ההטמעה של המתכות שנבדקו. ההסבר שניתן לתופעות אלו יוצג בהמשך.
יציבות כימית
במחקר זה נקשרה היציבות הכימית באופן הפוך לקצב (הסגולי) של התמוססות הברזל. קצבי ההמסה של כל הפֶריטים שיוצרו ב-90 מעלות, זולת אלה שהכילו קדמיום, ירדו עם העלייה במידת ההטמעה (איור 4). במילים אחרות, הטמעתן של כל המתכות הגבירה את היציבות הכימית של הפֶריטים, זולת קדמיום שהטמעתו גרמה דווקא לירידה ביציבות. לעומת זאת, איור 4 מראה כי קצבי ההמסה של פריטים שסונתזו בטמפרטורות של 30 מעלות ו-20 מעלות עלו משמעותית עם העלייה בכמות המתכת הזרה. אנליזה תרמו-גריבמטרית (TGA, מדידת מסה בעת חימום הדוגמה), הצביעה על נוכחות גבוהה של מים במבנה הגביש של פֶריטים שיוצרו בטמפרטורות נמוכות. מכאן, שהעלייה בקצבי ההתמוססות בפֶריטים אלה נבעה מנוכחות המים במבנה ולא כתוצאה מהטמעת המתכות.

הסבר אפשרי לתוצאות
הסבר אפשרי הן לקיבוע הנמוך יותר של מתכות הן לירידה ביציבות הכימית של פֶריטים ששוקעו בטמפרטורות הסביבה לעומת אלה ששוקעו בטמפרטורות גבוהות, כמו גם לאפקט החיובי של הגדלת היחס שבין ברזל דו-ערכי לתלת-ערכי, קשור למנגנון המורכב של תגובת השיקוע. נראה כי כאשר הפֶריטים שוקעים בטמפרטורות הסביבה, האינטראקציה שבין ברזל דו-ערכי לברזל תלת-ערכי (דילוג אלקטרון בין האחד לשני) שבתרכובת הביניים, דוחפת את סידור האטומים למבנה היציב של הפֶריט [9]. בטמפרטורות גבוהות, אינטראקציה זו ככל הנראה חשובה פחות, וגיבוש הפֶריט נעשה בעיקר דרך מנגנון של התמוססות תרכובת הביניים וגיבוש מחדש [12]. כאשר ברזל דו-ערכי מוחלף במתכת דו-ערכית אחרת בטמפרטורת הסביבה, יש פחות אינטראקציה בין אטומי הברזל ופחות "דחיפה" להסתדרות גביש הפֶריט. כתוצאה מכך נעצר הגיבוש, ומידת ההטמעה הסופית קטנה יותר. הגדלת היחס שבין ברזל דו-ערכי לתלת-ערכי מגבירה את הכוח הדוחף ליצירת פֶריט בטמפרטורת הסביבה, כך שמושג שיפור מסוים במידת הקיבוע המֵרבית. הקושי הגדל בסידור המולקולה כפֶריט, מקשה על היכולת לשחרר מולקולות מים כחלק מתהליך ההתגבשות. התוצאה של כל אלו היא ירידה ביציבות הגביש ועלייה בכמות חומרי הביניים הלא יציבים.
סיכום ומסקנות
תהליך הפֶריט הוא תהליך פשוט יחסית, המאפשר שחרור של מעל ל-98% מנפח השפכים בריכוזי מתכות מתחת לרמה הנדרשת בתקנות, תוך יצירת מוצקים יציבים ביותר, בעלי נפח קָטָן ועם פוטנציאל לשימוש מסחרי. בטמפרטורת הסביבה התהליך עובד היטב כל עוד מתקיים יחס גבוה יחסית של ברזל למתכת רעילה (5:1 לפחות). נמצא כי היחס שבין ברזל דו-ערכי לתלת-ערכי בתמיסה ההתחלתית הוא בעל משמעות גדולה בתנאים אלו. העלאת טמפרטורת התגובה תביא להקטנת כמות הברזל הנדרש ממקור חיצוני ותגדיל את היציבות הכימית, אולם במחיר של תוספת אנרגיה. כדאיות החימום צריכה להישקל אל מול העלות שבתוספת הכימיקלים. האפשרות לרכז את המתכות המומסות לנפח קָטָן באמצעות ספיחה מהירה בטמפרטורת הסביבה [17] עשויה להפוך את החימום למשתלם כלכלית. יש לזכור כי ריכוזי ברזל גבוהים מצויים בשפכי תעשייה רבים, ולכן ההשפעה הכלכלית של כמות הברזל החיצונית הדרושה יכולה להיות נמוכה מאוד.
תהליך הפֶריט יכול להיות חלופה אטרקטיבית לטיפול בשפכים המכילים מגוון מתכות. התהליך לא נמצא רגיש לנוכחות חומרים אורגניים כמו סבון. התגובה אפשרית בערכי הגבה של 9.0, התואמים לתנאי קולחים המשוחררים לסביבה. עלות התהליך לא נבחנה, אולם היא אינה אמורה להיות גבוהה מזו של תהליכי הקצה הנהוגים כיום. קרוב לוודאי שהקטנת נפחי הבוצה וההימנעות מהצורך בהטמנה יהפכו את התהליך לזול יותר משמעותית. מציאת שוק לפֶריטים עשויה כמובן להגדיל מאוד את האטרקטיביות של התהליך. אפשרות מעניינת נוספת היא השבה זולה יחסית של מתכות יקרות הספוחות על גבי הפֶריטים: תוצאות המחקר מלמדות שמתכות שהטמעתן במבנה הגבישי של הפֶריט נמוכה (קדמיום, כרום, נחושת, כספית, עופרת), יישארו ספוחות על פני השטח של הפֶריט. למתכות אלו ערך רב, והפרדתן מפני השטח של הפֶריטים יכולה להתבצע בקלות יחסית (שטיפה בחומצה). התוצר במקרה כזה יהיה תמיסה בעלת ריכוז גבוה של מתכות יקרות, שהפרדתן עשויה להיות אטרקטיבית ביותר.
המאמר דן בסוגיה של הרחקת מתכות משפכים תעשייתיים וכן בטיפול בתוצרי לוואי, כגון בוצות הנחשבות פסולת מסוכנת. לנוכח רעילותן של המתכות, מותרים ריכוזים נמוכים ביותר להזרמתן כשפכים. הקנסות על זיהום הסביבה מצד אחד, והערך הכלכלי של המתכות שבשפכים מצד שני, הם תמריצים משמעותיים לפיתוח טכניקות למִחזור ולהשבה של המתכות (כמוצר או כחומר גלם בתעשייה) כבר בתהליכי ההפקה והעיבוד השונים. סוגיה זו רלוונטית במיוחד לנוכח הדרישות הצפויות ממפעלי תעשייה במסגרת המנגנון, שמקים המשרד להגנת הסביבה, לטיפול סביבתי משולב במפעלים ובמתקנים תעשייתיים גדולים ובעלי רמת סיכון גבוהה. המנגנון יפעל לפי עקרונות ההנחיה המחייבת המעודכנת של האיחוד האירופי, IPPC (Integrated Pollution Prevention and Control, Directive 2010/75/EU), באמצעות קביעת הוראות ליישום "הטכניקה המיטבית הזמינה" (BAT – Best Available Technology).
במאמר מוצגת טכנולוגיה של "תהליך הפֶריט" (ferrite) המתבססת על שיקוע של מגנטיט – תחמוצת ברזל טבעית בעלת משקל סגולי גבוה ותכונות מגנטיות. תהליך הפֶריט הוא תהליך פשוט יחסית, המאפשר טיפול במַרבית השפכים והבאתם לריכוזי מתכות מתחת לרמה הנדרשת בתקנות, תוך יצירת מוצקים יציבים ביותר, בעלי נפח קָטָן, שיש להם פוטנציאל לשימוש מסחרי. תהליך הפֶריט יכול להיות חלופה אטרקטיבית לטיפול בשפכים המכילים מגוון מתכות, בְּעלוּת דומה לזו של תהליכי הקצה הנהוגים כיום.
מערכת אקולוגיה וסביבה
לאור זאת, ייתכן שיתאים להגדרת "הטכניקה המיטבית הזמינה" דלעיל. כמו כן, המאמר מעלה אפשרות להשבה קלה וזולה יחסית של מתכות יקרות הספוחות על גבי הפריטים, כגון קדמיום, כרום, נחושת, כספית ועופרת.
מקורות
- ובר ב. 1998. צמצום מפגעים סביבתיים מתעשיית ציפוי מתכות. ירושלים: המשרד להגנת הסביבה.
- המשרד להגנת הסביבה. 2004. מתכות כבדות בשפכי תעשייה. נצפה ב-4 בספטמבר 2011.
- תקנות בריאות העם (איכותם התברואית של מי שתיה) תשל"ד. 1974.
- תקנות המים (מניעת זיהום מים) (מתכות ומזהמים אחרים) התשס"א. 2000.
- Casarett LJ, Klaassen CD, Amdur MO, and Doull J. 1996. Casarett and Doull's toxicology : The basic science of poisons, 5th ed. New York: McGraw-Hill, Health Professions Division.
- Deorkar NV and Tavlarides LL. 1998. An adsorption process for metal recovery from acid mine waste: The Berkeley Pit problem. Environmental Progress 17(2): 120-125.
- Egiebor NO and Oni B. 2007. Acid rock drainage formation and treatment: A review. Asia-Pacific Journal of Chemical Engineering 2(1): 47-62.
- Helm L and Merbach AE. 1999. Water exchange on metal ions: Experiments and simulations. Coordination Chemistry Reviews 187: 151-181.
- Jolivet JP, Tronc E, and Chaneac C. 2006. Iron oxides: From molecular clusters to solid. A nice example of chemical versatility. Comptes Rendus Geoscience 338(6-7): 488-497.
- Kiyama M. 1978. Formation of manganese and cobalt ferrites by air oxidation of aqueous suspensions and their properties. Bulletin of the Chemical Society of Japan 51(1): 134-138.
- Klas S. 2010. Removal of heavy metals by their stable incorporation into ferrites at ambient temperature: Process development and modeling (PhD dissertation). Haifa: Technion, Israel Institute of Technology.
- Klas S, Dubowski Y, and Lahav O. 2011. Chemical stability and extent of isomorphous substitution in ferrites precipitated under ambient temperatures. Journal of Hazardous Materials. in press.
- Klas S, Dubowski Y, Pritosiwi G, Gerth J, Calmano W, and Lahav O. 2011. Extent and mechanism of metal ion incorporation into precipitated ferrites. Journal of Colloid and Interface Science 358: 129-135.
- Magalhaes JM, Silva JE, Castro FP, and Labrincha JA. 2005. Physical and chemical characterisation of metal finishing industrial wastes. Journal of Environmental Management 75(2): 157-166.
- McKinnon W, Choung JW, Xu Z, and Finch JA. 2000. Magnetic seed in ambient temperature ferrite process applied to acid mine drainage treatment. Environmental Science & Technology 34(12): 2576-2581.
- Morel F and Hering JG. 1993. Principles and applications of aquatic chemistry. New York: Wiley.
- Morgan BE, Lahav O, and Loewenthal RE. 2005. Advances in seeded ambient temperature ferrite formation for treatment of acid mine drainage. Environmental Science and Technology 39(19): 7678-7683.
- Petrick, L, Dubowski Y, Klas S, and Lahav O. 2008. Stable incorporation of Co2+ into ferrite structure at ambient temperature: Effect of operational parameters. Water Air and Soil Pollution 190(1-4): 245-257.
- Regazzoni AE, Urrutia GA, Blesa MA, and Maroto AJG. 1981. Some observations on the composition and morphology of synthetic magnetites obtained by different routes. Journal of Inorganic and Nuclear Chemistry 43(7): 1489-1493.
- Zinck J. 2005. Review of disposal, reprocessing and reuse options for acidic drainage treatment sludge. MEND Report 3.42.3, Natural resources Canada.







 מהדורה מודפסת
מהדורה מודפסת












