סקירות
הלובסטר הים תיכוני, כפן גושמני – הידוע והנסתר באקולוגיה של מין מאוים

הלובסטר, כפן גושמני – הסרטן הגדול ביותר בחופינו הים תיכוניים | צילום: יגאל שטסל
הלובסטר, כפן גושמני, הוא הסרטן הגדול ביותר בחופינו הים תיכוניים, ותפוצתו כוללת את כל הים התיכון ומזרח-מרכז האוקיינוס האטלנטי. הכפן הגושמני הוא ערך טבע מוגן ומין דגל בישראל, ולמרות זאת הוא מאוים בגלל דיג יתר, הרס בית הגידול של הבוגרים ושינוי האקלים. בחורף הוא שוהה ברכסי הכורכר, שם הוא חוסה במשך היום במחילות ובמערות אפלות ומסתתר מטורפים פעילי יום כמו הדג נִצרן ים-תיכוני. פעילותו הלילית, שריונו העבה, צבע ההסוואה שלו, יכולת ההיצמדות שלו למצע הסלעי ושחיית ההימלטות המהירה בעת חירום, הם בין ההתאמות הנוספות שיש לו כנגד טריפה. הוא ניזון בעיקר מצדפות. הוא מלקט אותן בלילה בשטח הפתוח, ופותח את קשוותיהן בציפורני רגליו החזקות. הזוויגים נפרדים, והרבייה באביב. הנקבה מטילה עשרות אלפי ביצים זעירות הנישאות על בטנה. מן הביצה בוקעת פגית זעירה, החיה וניזונה בים הפתוח, וצורתה כעלה קטן שקוף. היא חיה כשנה הרחק מהחוף, ועוברת מספר התנשלויות, עד שהיא מגיעה לשלב של קדם-צעיר. כפן זעיר זה שוקע לקרקעית הים העמוקה, ובהדרגה גדל ונע לכיוון המים הרדודים, שם הוא מצטרף לבסוף לאוכלוסיית הבוגרים. בעונות החמות הכפנים הבוגרים נודדים למים עמוקים וקרים יותר, שם התנאים מתאימים יותר להתנשלות המאפשרת גידול. יש ידע מוגבל על חושיו הכימיים, המכניים וראייתו של הכפן הגושמני, ולא ידוע כמעט דבר על הביולוגיה והאקולוגיה של שלבי החיים הצעירים של לובסטר זה. שמורות טבע ימיות מוגנות מדיג הוכחו כאמצעי הטוב ביותר לשימור ולאישוש של אוכלוסיות כפן גושמני. כדי להגן כראוי על מין מאוים יש צורך במרב המידע על הביולוגיה והאקולוגיה שלו. כיום נעשה ניסיון לגייס את קהל חובבי הים לספק מידע למדענים על חלק מהשאלות שנותרו פתוחות לגבי מין ימי חשוב ויפה זה.
על קצה המזלג
- הלובסטר כפן גושמני הוא טורף הניזון בעיקר מצדפות. הוא מאוים על-ידי גורמים מקומיים, כגון דיג, וכנראה גם על-ידי תהליכים עולמיים כגון התחממות האוקיינוסים.
- מיעוט הידע על היבטים שונים בחיי מין זה, לצד קושי אובייקטיבי באיסוף המידע על הביולוגיה והאקולוגיה שלו, מקשים על מתן הגנה ראויה עליו.
- הדרך היעילה ביותר שנמצאה להגנה על הכפן הגושמני, הנחשב בישראל למין מוגן, היא באמצעות שמורות טבע ימיות.
מערכת אקולוגיה וסביבה
הלכה למעשה
אלון רוטשילד, מנהל תחום המגוון הביולוגי, החברה להגנת הטבע:
המאמר חושף את מחזור החיים המרתק של הכפן הגושמני. הכפן עובר מהים הרדוד לעמודת המים של הים הפתוח, ממנה לקרקעית הים העמוק, ומשם בתנועה רגלית על קרקעית הים עד לשוניות הרדודות. זו דוגמה לצורך בניהול מרחבי אינטגרטיבי של הטבע הימי. מהצורך הזה ניתן לגזור מסקנות, התומכות במדיניות שמירת הטבע הנוכחית בישראל:
- יש לקדם שמורות טבע ימיות נרחבות, ללא דיג, המקיפות טווח עומקים נרחב ורציף מהמים הרדודים ועד לים העמוק.
- קידום שמורות טבע בתחום האזור הכלכלי הבלעדי בהתאם לתוכנית האב [1] צפוי לתמוך גם באוכלוסיית הכפן הגושמני, המבלה חלק ממחזור החיים שלו בעומק.
- מחוץ לשמורות ימיות חשוב לשמר את איכות בית הגידול ואת הקישוריות האקולוגית בין מרחבי הים המשמשים להגירת הכפנים:
- יש להשבית את דיג המכמורת על פני כל המרחב הימי של ישראל, כפי שכבר נעשה משנת 2016 בשליש הצפוני של המים הריבוניים (מצפון לחוף דור). רשת המכמורת חורשת את הקרקעית והיא בעלת פוטנציאל לקטוע את תנועת הכפנים ולפגוע בהם בהגירה מהעומק למים הרדודים וחזרה.
- יש להטמיע פרקטיקות מתקדמות להגנה על השלב הפלנקטוני, בהתבסס על מחקר, למשל מיתון השפעות סביבתיות של סקרים סיסמיים לחיפושי גז, שהוכחו כבר כפוגעים בפלנקטון בעמודת המים.
נוסף על כך, הציבור מוזמן להשתתף במדע למען הים, באמצעות דיווח על תצפיות ביישומון SeaWatch של החברה להגנת הטבע. דיווחים על מפגעים סביבתיים ותצפיות בבעלי חיים מועברים אוטומטית אל גורמי הטיפול והמחקר, בהתאם לסוג הדיווח. למשל, דיווח על תצפית בכפן גושמני נשלח ישירות אל קבוצת המחקר שבהובלת פרופ' אהוד שפניר, לצורך ניטור מצב האוכלוסייה בישראל.
מקורות
1. שבתאי ע, רוטשילד א, עמיר ד ואחרים. 2023. תכנית אב לשמורות טבע ימיות באזור הכלכלי הבלעדי בים התיכון
מבוא: אפיוני הכפן
כפן גושמני (Scyllarides latus [Latreille, 1803]) מוכר גם בשם הלובסטר הים תיכוני (Mediterranean slipper lobster). אם תצללו בשעות היום ברכסי הכורכר הטבועים של חלק מחופינו הים תיכוניים, קרוב לוודאי שלא תבחינו בו. צבעו חום-צהבהב, שולי מחושיו השטוחים (ה"כפות"), המחושונים והרגליים לרוב בצבע סגול בולט (איור 1). כלובסטרים אחרים בעולם, הוא פעיל בלילה, ובמשך היום הוא מסתתר במערות, במחילות ובנקיקים חשוכים במצע הסלעי [1, 29, 33]. בחופינו הוא מצוי בעומקי צלילה (עד כ-30 מטר) קרוב לחוף רק בחלק מהשנה, בערך מפברואר עד יולי, אבל במהלך רוב הקיץ ובסתיו נדיר לראותו בחלק הרדוד של מדף היבשת הים תיכוני [27, 29, 33]. לאן הוא נעלם ומדוע? ככל הנראה, הוא נודד לאזורים עמוקים יותר וחוזר שוב לבית הגידול הרדוד בחורף הבא. פרטים בודדים של כפנים שסומנו בשוניות מלאכותיות בישראל בעומק 20 מטר, ונתפסו שוב אחרי כמה חודשים במרחק עשרות קילומטרים מאתר הסימון, עשויים לתמוך בהנחה זו. גם תפיסת כפנים (לא מסומנים) באוקטובר במלכודת בעומק 48 מטר ובטמפרטורת מים של 23.6 מעלות צלזיוס, כאשר לא היו כלל כפנים בבית הגידול הרדוד, שבאותה עת שררה בו טמפרטורה של 27.7 מעלות [27], עשויה לתמוך בהשערה זו. באיים האזוריים נמצא שכפנים גושמניים עברו מעומק מים רדוד (5–20 מטר) לעמוק יותר (70–75 מטר) בסתיו, וחזרו למים הרדודים באביב. מה שמצביע על נדידה אנכית גם שם [19]. בסיציליה הסיקו החוקרים, בהתבסס על תפיסה מחדש של 29 כפנים מסומנים, שהם נשארים "באזור הכללי הקרוב". אף על פי שפרט אחד שסומן בעומק 15 מטר, נתפס ברשת עמידה אחרי יותר מארבע שנים במרחק 5 ק"מ מאתר הסימון ובעומק רב יותר (70 מטר), החוקרים שם לא שללו נדידה אנכית [5]. במחקר בשמורת טבע באיים הבלאריים [9] נמצאה עונתיות נכרת – היעדר כפנים במים הרדודים יחסית (0–50 מטר) בחורף. בהתבסס על 10 כפנים מתויגים אקוסטית הסיקו החוקרים שטווח תנועתם של הכפנים מוגבל, ובחורף הם מצויים עמוק במערות תת-מימיות ופעילותם נמוכה. תאוריה זו של תרדמת חורף התבססה על כך שטמפרטורת המים במערות בחורף הייתה גבוהה משמעותית מהטמפרטורה מחוץ להן. עם זאת, יש לזכור שטמפרטורות המים בלבנט, קצה תפוצתם הגאוגרפית של הכפנים, גבוהה הרבה יותר מזו שבמערב הים התיכון.
אורכו המרבי של הכפן עשוי להגיע עד 45 ס"מ, אם כי לרוב אינו עולה על 30 ס"מ, ומשקלו עד כק"ג וחצי. הוא נפוץ על קרקע סלעית, לרוב בעומקים של כ-4 עד 100 מטר [12] (אך עשוי להגיע עד עומק של 400 מטר [22]) בכל הים התיכון ובמרכז מזרח האוקיינוס האטלנטי, מחופי פורטוגל לסנגל, מדירה, האיים האזוריים, האיים הקנריים וכף ורדה [12]. בעשורים האחרונים דווח על ירידה בגודל הממוצע והמרבי של כפנים בוגרים, ככל הנראה עקב לחץ דיג בררני שכוון לפרטים גדולים [29]. הוא היה, ועודנו, יעד לדיג כסרטן הגדול ביותר בחופינו ובכל דרום-מזרח הים התיכון.
הכפן הגושמני שייך לסוג כפן (Scyllarides), שבו 14 מינים החיים בימים ממוזגים וטרופיים. משפחת הכפניים (Scyllaridae) היא המגוונת ומרובת המינים יותר משאר קבוצות הלובסטרים. היא כוללת ארבע תת-משפחות ולפחות 89 מינים. הכפנים קרובים מבחינה טקסונומית ללובסטרים הקוצניים (Palinuridae), וללובסטרים הפרוותיים (Synaxidae), שיחד מהווים את קבוצת הלובסטרים חסרי הצבתות (Achelata) [15], ולכולם פגית (לרווה) מיוחדת (phyllosoma) (איור 2).
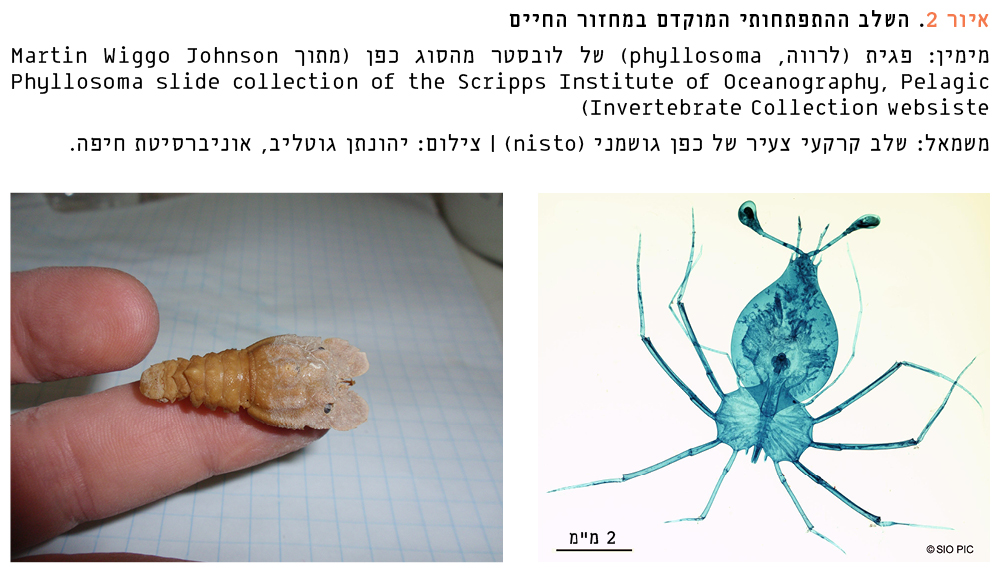
איור 2
השלב ההתפתחותי המוקדם במחזור החיים
מימין: פגית (לרווה, phyllosoma) של לובסטר מהסוג כפן (מתוך
משמאל: שלב קרקעי צעיר של כפן גושמני (nisto) | צילום: יהונתן גוטליב, אוניברסיטת חיפה.
רבייה והתפתחות
אצל פרטים בוגרים קל להבחין בהבדלים בין הזוויגים על-ידי בדיקת הצד התחתון של הגוף. לנקבה יש שלוחות בטן (pleopods) גדולות ורחבות יותר מאשר לזכר, והן משמשות להחזקת הביצים. רגל ההליכה החמישית, המשמשת לטיפול בביצים, מסתיימת אצל הנקבה בצבת, בעוד אצל זכר היא מסתיימת בציפורן. פתחי המין מצויים בבסיס רגל ההליכה השלישית אצל הנקבה והחמישית אצל הזכר. עונת הרבייה היא באביב ובתחילת הקיץ. באביב המוקדם, כשטמפרטורת המים הגיעה לפחות ל-17 מעלות, נצפו בדרום-מזרח הים התיכון בים ובמעבדה זכרים עם תיקי זרע (spermatophores) ג'לטיניים לבנים על בסיס רגלי ההליכה הרביעית והחמישית. ההזדווגות איננה קשורה להתנשלות כמו במספר מיני לובסטרים אחרים. נקבות במעבדה נצפו עם תיקי זרע 8–10 ימים לפני הופעת הביצים. נקבות נושאות ביצים דווחו בים ובמעבדה בחודשים מאי–יולי כשטמפרטורת המים 17–27 מעלות. קוטר הביצה כ-7 מ"מ, ומספר הביצים 100,000–356,000 לנקבה, והוא עומד ביחס ישר לגודל הנקבה [17, 27, 33]. שיעורי פוריות גבוהים כאלה עשויים להיות התאמה לאובדן של פגיות בים הפתוח וגיוס משתנה של צעירים עקב שינויים מחזוריים בים [24]. צבע הביצים צהוב-כתום, והוא נעשה בהמשך חום כהה. הנקבות נושאות את הביצים על בטנן בחופי ישראל במשך 4–6 שבועות [1], ובאוקיינוס האטלנטי במשך 6–8 שבועות [22] לפני שחרורן למים. דווח כי הן עלולות לאבד חלק מביציהן ואף את כולן לאחר הטרדה, איום מצד טורף או אחיזה תדירה ביד אדם בים או במעבדה [19, 27]. מהביצה בוקעת פגית ראשונית (naupliosoma) באורך של כ-1.3 מ"מ, שאיננה ניזונה, ומתקיימת לא יותר מחמש שעות עד שהיא מתנשלת לשלב הראשון של פגית [20]. הפגית בשלב זה חיה כ-6 ימים, ואורכה כ-1.8 מ"מ. הפגית שטוחה, שקופה ודמוית עלה (איור 2), והיא צפה בים הפתוח, הרחק מהחוף, ניזונה מהחי (בדרך כלל מיצורים רכים וג'לטיניים), ועוברת 11 נשלים וגידול במשך קרוב לשנה. השלב הסופי שלה, שעשוי להגיע עד לאורך 48 מ"מ [20], הופך לקדם-צעיר (nisto). שלב זה הוא המעבר מחיים פלנקטוניים לחיים בנתוניים (קשורים למצע). לא דווח על מציאת שלב זה בטבע, אולם חיפוש ממושך באוספים מוזאוניים חשף שלב כזה במוזיאון הזואולוגי בטורינו [30]. פרט נדיר זה, באורך 38.7 מ"מ (איור 2, משמאל) נדגם בדרום איטליה בראשית המאה ה-20, כנראה במים עמוקים מ-800 מטר. מניחים שבני שלב זה נעים בהליכה על הקרקעית העמוקה לעבר המים הרדודים תוך התנשלות וגדילה, עד שהם מצטרפים לאוכלוסיית הצעירים והבוגרים במי החופים. למרות שהכפנים מזדווגים, מטילים ביצים ומדגירים אותן בקלות בתנאי שבי, לא עלה בידי החוקרים לגדלם מביצה במעבדה.
מחקר גנטי ראשוני שהשווה בין כפנים מאתרים שונים סביב סיציליה ואף כלל פרטים מישראל ומהאיים האזוריים [6], הצביע על היעדר שונות גנטית בין האתרים. מחקר נרחב יותר כלל כפנים גושמניים מ-15 אתרים במזרח האוקיינוס האטלנטי ובמערב הים התיכון [10]. הממצאים הצביעו על היעדר שונות גנטית בין הכפנים בטווח התפוצה הרחב שנבדק. כלומר, יש לנו פה תופעה של panmixia – היכולת של פרטים באוכלוסייה להתרבות ללא הגבלות על פני טווח גאוגרפי גדול מאוד של מאות עד אלפי קילומטרים. החוקרים ייחסו זאת לפוריות הרבה של הכפן הגושמני ולשלב הממושך של הפגיות בים הפתוח.

חושים
עולם החושים של הכפנים הבוגרים מוכר פחות בהשוואה לזה של קבוצות לובסטרים אחרים. החוש הכימי מחולק בשאר הלובסטרים לתחושה כימית מרחוק ("ריח") ומקרוב ("טעם"). בתצפיות בהתנהגות האכילה של הכפנים, נראה שהפרדה זו אצלם אינה ברורה [18]. יש להם גדילים של שערות חישה במקומות רבים בגוף, אך לא בקצות הרגליים. למרות זאת, הם מסוגלים לאתר ולשלוף, באמצעות ציפורני רגלי ההליכה, צדפות המתחפרות בעומק של כ-3.5 ס"מ בקרקע [27] תוך הגברת קצב רפרוף המחושונים שלהם, והדבר קורה גם כאשר מוכנס מזון לאקווריום שלהם במעבדה. המחושונים מכוסים במספר סוגים של גדילי שערות חישה, המשמשים, ככל הנראה, כקולטנים כימיים ומכניים [39]. הקולטנים המכניים משמשים גם לחישה הידרודינמית של זרמי מים בעת שחיית ההימלטות, וכך גם גדילי שערות החישה הרבים על ה"כפות" של הכפן (זוג המחושים השני השטוח) המשמש להיגוי בעת ה"המראה", ה"נחיתה" ושינוי הכיוון בשחייה. הצד התחתון ובעיקר הצד הגבי של השלד החיצוני של הכפנים, כמו אלה של סרטנים מעשירי רגליים אחרים, מכוסים בגדילי שערות חישה נוקשים רבים, וגם הם, כנראה, קולטנים מכניים.
העיניים, הממוקמות על גבעולים, מאפשרות מבט אחורה. העובדה שעיניהם גדולות, וממצאי מחקר אנטומי על עיני הכפן [13] הצביעו על כך שהן דומות לאלה של סרטנים מעשירי רגליים ליליים, ומותאמות לראייה באור עמום. יש להם, ככל הנראה, גם יכולת ראייה של אור מקוטב, התאמה חשובה בהתחשב בכך שכמה מינים של דגי נִצרן, ובהם טורפים פוטנציאליים של הכפנים, ניחנים ביכולת כזו.
איברי שיווי משקל (סטטוציסטים, statocysts) קיימים במשפחות אחרות של לובסטרים ומשמשים כדי לשמור על איזון, אך לא נערך עדיין מחקר בנושא על כפנים. אם הופכים כפן גושמני על הגב הוא מייד מגיב במכת בטן שרירית כדי להתהפך [18], ועובדה זו רומזת לכך שהאיברים האלה מפותחים היטב גם אצל הכפנים.
כיוון שנראה שהכפנים מסוגלים לחזור לאותה מחילה סלעית (או בשונית מלאכותית) לאחר שנה [21, 26] או אף מספר שנים [33], נשאלת השאלה איך הם מנווטים למרחקים כאלה גדולים? ייתכן שהם משתמשים ברמזים מגנטיים או ב"מפה" גאומגנטית, כפי שדווח לגבי לובסטרים קוצניים [7], אך גם פן זה טרם נחקר. לא ברור גם אם הכפנים משמיעים קולות ושומעים קולות כמו מספר מינים אחרים של לובסטרים. גם המנגנונים החושיים של שלבים צעירים של כפנים אינם מוכרים.


תזונה, טורפים והתאמה כנגד טריפה
הכפן הגושמני משחר למזון בלילה וניזון בעיקר מצדפות [25]. לעיתים הוא מביא צדפות לסביבה המוגנת יחסית בתוך מחילתו, כנראה כאלה שליקט לקראת שחר [29]. הכפנים פותחים את הצדפות בעזרת ציפורני רגליהם החזקות, לאחר שבחנו אותן במחושוניהם וחתכו את שרירי הסגירה שלהן [18].
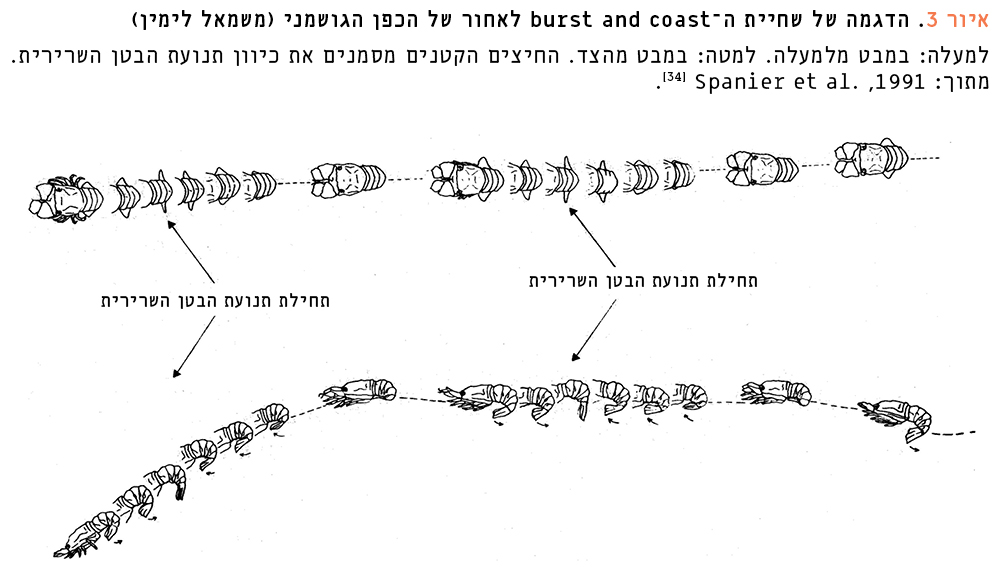
לעומת לובסטרים בעלי ערך מסחרי אחרים בעולם, הכפנים נראים במבט ראשון חסרי הגנה. לובסטרי הצבתות, למשל לובסטר הצבתות האמריקאי, מצוידים בצבתות גדולות המשמשות להגנה (כמו גם לאחיזה ולפיצוח מזון). הלובסטרים הקוצניים, כמו המחושתן הקוצני ממפרץ אילת, הם בעלי מחושים ארוכים וקוצניים שעשויים להבריח טורפים, וגופם מכוסה שריון קוצני. במבט ראשון נדמה שלכפנים אין התאמות מורפולוגיות כנגד טורפים, אולם התברר שיש להם התאמות מורפולוגיות וגם התנהגותיות כנגד טריפה. ראשית, הם חוסים ביום במחילות אופקיות, מוצלות, מה שמגן עליהם מאיתור ומפגיעה פיזית, בדרך כלל מצד טורפים פעילי יום. הם מעדיפים מחסות טבעיים או מלאכותיים (שוניות מלאכותיות) שיש בהם לפחות שני פתחים [26]. הם נוטים לבחור מחילות עם פתחים קטנים, שמגבירים את ההגנה הפיזית של המחילה וגם מוסיפים להצללה שלה. הכפנים חוסים לרוב במחילות עם פרטים אחרים בני מינם [18]. כשהם יוצאים לפנות ערב לשם שיחור מזון או לאינטראקציות חברתיות, צבעם מתמזג עם צבע הסביבה הסלעית באור הדמדומים. אם הם מאותרים ומותקפים, שריונם העבה (השלד החיצוני) עשוי להגן עליהם בתחילת התקיפה של טורף פעיל יום טיפוסי, כמו דג הנִצרן הים-תיכוני בעל השיניים החזקות. התברר ששריונם המחוספס עבה לפחות פי שניים משריונם של לובסטרי צבתות ולובסטרים קוצניים [3]. יש לו גם מבנה מיוחד [38] שעושה אותם עמידים הרבה יותר לפגיעה מכנית מאשר מיני לובסטרים אחרים. בזמן תקיפה הם מגינים על גפי הפה והמחושנים הרגישים באמצעות המחושים השטוחים והנוקשים (ה"כפות"), ועיניהם שוקעות לתוך ארובות העיניים המוגנות בקוצים חזקים. הם משתמשים ברגליהם הקצרות והחזקות, המצוידות בציפורניים חזקות, כדי להיאחז בקרקעית הסלעית או בכתלים ובתקרה של המחילה, ומנסים למנוע מהטורף להפוך אותם ולחשוף את חלק גופם התחתון, שם שריונם דק ופגיע יותר. מדידות ניסיוניות, באמצעות מאזני קפיץ, הצביעו על כך שכוח ההיצמדות של הכפנים למצע סלעי מחוספס (הנמדד ככוח הדרוש לניתוק הכפנים ממצע כזה) נע בין 3–15 ק"ג, ויש התאמה לינארית לגודל (למשקל) הכפן. כוח ההיצמדות שווה ערך לפי 8–29 ממשקל הגוף של הכפן [27]. ניסויים בים הראו שהשרידות של כפנים שחסו במשך היום במחילות בשונית מלאכותית הייתה גבוהה משמעותית מזו של כפנים ששהו באותו זמן בשטח פתוח, ושרובם נטרפו על-ידי נִצרנים ים-תיכוניים [4]. אם אסטרטגיה זו של "הגנת מבצר" איננה מצליחה להתמודד עם הטורף, או שהטורף מצליח לחדור למחילה, הכפנים נמלטים מהפתח החלופי שלה, ועוברים לשחיית הימלטות. הכפנים שבדרך כלל נעים באיטיות בהליכה על פני המצע, משתמשים בעת חירום בשחייה מהירה באמצעות מכות הבטן השרירית והגמישה שלהם. שחייה זו, המניעה את הכפן במהירות לאחור בתגובה לאיום, היא מטיפוס burst and coast. היא מורכבת מתנועות נמרצות במשרעות גדולות של הבטן השרירית ואחריהן גלישה ללא הפעלת כוח (איור 3). התאוצה יכולה להגיע למהירויות מרביות של שלושה אורכי גוף בשנייה (עד כמטר אחד לשנייה) בעוד שההאטה במהלך הגלישה יורדת למהירויות של פחות מאורך גוף אחד לשנייה [34]. הם גם עשויים לשנות בפתאומיות את כיוון השחייה שלהם, ככל הנראה כדי לבלבל את הטורף הרודף [34]. שחיית בריחה זו מיועדת לטווח קצר, והכפן משתמש בה רק במצבי חירום כדי להגיע למקום מבטחים (מחילה חלופית), שכן היא דורשת השקעת אנרגיה רבה. המחושים בזוג השני, הפחוס (הקרויים בטעות "כפות" או "סנפירים"), עם מפרקיהם בני-התנועה, משמשים מייצבים או הגאים לשליטה בתנועת השחייה [34]. ייתכן שגם למניפת הזנב (telson) תפקיד בהיגוי ובייצוב בעת השחייה.
איור 3
הדגמה של שחיית ה-burst and coast לאחור של הכפן הגושמני (משמאל לימין)
למעלה: במבט מלמעלה. למטה: במבט מהצד. החיצים הקטנים מסמנים את כיוון תנועת הבטן השרירית. מתוך: Spanier et al., 1991 [34].
התאמות נוספות כנגד טריפה הן התחזות למת (חוסר תזוזה בתגובה לטורף חולף) [16] ונטייה של הכפנים להתקבץ ביחד בשטח פתוח בלילה או במחילה משותפת ביום. ההתקבצות בשטח פתוח בלילה עשויה לעכב את התקיפה, לבלבל את הטורף לזמן קצר ולתת לכפנים זמן נוסף להימלטות בשחייה. שחיית בריחה כזו של כפנים למספר כיוונים, תבלבל עוד יותר את מערכת החישה של הטורף ותקשה עליו להתמקד בפרט יחיד [16]. פרטים המתקבצים בקבוצות עשויים להפחית את הסיכון לטריפה לפרט מאשר כפן בודד בגלל אפקט הדילול של פרט בתוך קבוצה ועקב זיהוי הטורף הודות לערנות מוגברת מצד קבוצת הכפנים [14, 16].
טורף פוטנציאלי נוסף של הכפנים הוא תמנון החוף (Octopus vulgaris). באופן מפתיע, פעמים רבות נצפו כפנים ביחד עם הדג דמוי הצלופח, מורנה ים תיכונית (Muraena helena), באותה מחילה ללא כל יחסים של טורף–נטרף ביניהם [18, 26]. המחסה המשותף עשוי להועיל לשני המינים כיוון שהתמנון הוא טרף של המורנה. כך, הכפנים עשויים להיות מוגנים מפני התמנון על-ידי שכנם למחילה – המורנה, ואילו המורנה עשוי ליהנות מכל תמנון הנמשך למחילה בגלל נוכחות הטרף שלו – הכפנים. עם זאת, יש להמשיך ולחקור קשר זה כדי להבהיר יחסי הגומלין.
איומים, השפעות סביבתיות ושימור
הכפן הגושמני הוא "מין דגל" (בעל חשיבות מבחינת תודעת הציבור כדולפינים וכרישים) מוגן. יש לו חשיבות רבה למערכת האקולוגית הימית כטורף וכנטרף וכן ביחסי הגומלין שלו עם יצורים אחרים ובשחרור מיליוני ביצים ופגיות לים הפתוח. הוא פיתח התאמות מורפולוגיות, פיזיולוגיות והתנהגותיות המועילות לשרידותו כנגד טורפים טבעיים, אך הן תורמות פחות להתמודדותו כנגד "הטורף המודרני" – האדם. האיומים העיקריים על הכפן הגושמני הם דיג יתר, פגיעה בבית הגידול ושינוי האקלים [17]. בגלל גודלם ומחירם הגבוה בשוק, הכפנים נידוגו באופן אינטנסיבי בכל תחום תפוצתם [28], כולל בישראל, בעיקר באמצעות צלילה ודיג ברשת עמידה. דיג של פרטים גדולים בעלי פוטנציאל רבייתי גבוה פוגע חמורות במין זה, עד כדי כך שמעריכים שבאזורים מסוימים במערב הים התיכון האוכלוסייה לא תוכל להשתקם כלל [8]. בישראל נחשב הכפן הגושמני לערך טבע מוגן מ-2005, אך עדיין יש שדגים אותו. בגלל המרחב הימי הגדול ומיעוט הפקחים הדרך היעילה ביותר להגן עליו היא באמצעות שמורות טבע ימיות, ויש להוסיף שמורות רבות וגדולות בבתי הגידול המתאימים. במחקר שנערך בשמורת ים ראש הנקרה–אכזיב ובאזור ביקורת דומה [21], נמצאה עונתיות ברורה, וכן נמצא שמספרם, צפיפותם וגודלם של הכפנים בשמורה היה גבוה יותר מאשר באזור הביקורת. כפנים מסומנים נטו לחזור חזרה בחורף לאותן מערות בשמורה, אך לא באזור הביקורת. מניחים שהשמורות מיטיבות גם עם אזורים מחוץ להן על-ידי זליגה של בוגרים, צעירים ופגיות לשטחים בלתי מוגנים. בדומה לכך, בעקבות מחקר ממושך ומעמיק שנערך בשמורת הטבע הימית PNMTAC באיים הבלאריים, נצפתה נאמנות למערות המקוריות, והומלץ להגביל פעילות אנושית, בעיקר דיג וצלילה, בדגש על עונת הרבייה של הכפנים שם (אפריל–יולי) [23]. פגיעה בבתי גידול סלעיים המועדפים על הכפנים, כדוגמת הרס רכסי הכורכר הטבועים המשופעים במערות, בנקיקים ובמחילות [35], היא גורם נוסף הפוגע בכפנים. ההגנה על בתי גידול אלה, גם מחוץ לשמורות, הכרחית לשימור הכפנים ויצורים מאוימים אחרים. שוניות מלאכותיות יציבות ובטוחות סביבתית, הבנויות בהתאם לאקולוגיה ההתנהגותית של הכפנים, עשויות לספק מחילות מתאימות לכפנים ולהוות תחליף מסוים לבתי גידול טבעיים שנהרסו [31].

עליית הטמפרטורה התלולה של מי הים במדף היבשת הרדוד באזורנו בשנים האחרונות בעקבות שינוי האקלים לערכים של מעל 31 מעלות [35] עלולה להזיק לכפנים. לאחר שהכפנים הוחזקו במשך חודשיים במעבדה במכל עם מי ים בטמפרטורה של 26 מעלות או יותר, ההתנשלות במעבדה לעיתים הסתבכה [36], הייתה חלקית, ואף הסתיימה במוות [18]. כפנים שהוחזקו במים של פחות מ-24 מעלות תפקדו כרגיל. ייתכן שעליית הטמפרטורה גורמת לכפנים לנדוד בעונות החמות למים עמוקים וקרים יותר, שיאפשרו להם התנשלות נורמלית מבחינה פיזיולוגית. השלת השריון הישן וגידול שריון חדש תחתיו מאפשרים לכפן לגדול. בעת ההתנשלות הכפן חשוף יותר לטריפה. ייתכן שהנדידה המשוערת שלהם לעומק קשורה גם ללחץ הטריפה המופחת הקיים בחשכת המעמקים. המידע על עיתוי ההתנשלות בים חלקי ביותר, ומבוסס על נשלים בודדים שנמצאו בחוף, בעיקר בתחילת החורף [29]. במחקר במעבדה [11] נמצא שהכפנים מגבירים את פעילותם כשטמפרטורת המים עולה על 24 מעלות. מרחק ההליכה שלהם ליום במערכת מדידה במעבדה היה גבוה באופן משמעותי (עד יותר מפי שלושה) בטמפרטורות הגבוהות לעומת המרחק בטמפרטורות מועדפות על הכפנים (20–23 מעלות). ממצאים אלה עשויים לרמוז כי עליית טמפרטורות המים באגן הלבנט עלולה להשפיע על תנועות הכפנים ולשנות גם את דפוסי התפוצה העונתיים שלהם, למשל לגרום להם לנדוד למים עמוקים מוקדם יותר בשנה. שינוי האקלים עלול גם להגביר את תדירותם ועוצמתם של אירועי אקלים קיצוניים כמו סערות [35]. החפה (stranding) של כפן גושמני בעקבות שתי סערות גלים עזות דווחה לראשונה בחופי צפון הארץ בשנים האחרונות [32]. כדאי לבדוק גם אם חל שינוי בתזונת הכפנים בהתחשב בכך שאוכלוסיות הצדפות המקומיות נעלמה כמעט לחלוטין והוחלפה במינים ים סופיים קטנים יותר [37].
לאור המחקר הגנטי המצביע על קישוריות גבוהה בין אוכלוסיות מרוחקות גאוגרפית של הכפן הגושמני [10], אסטרטגיות שימור עתידיות צריכות לנהל את כל אוכלוסיות מין זה במשותף (מלאי אחד). הכפן הגושמני מוגדר ברשימה האדומה של מינים מאוימים של האיגוד הבין-לאומי לשימור הטבע (IUCN) כ"חסר נתונים" [8]. כדי להגן כראוי על מין מאוים יש צורך במרב המידע על הביולוגיה והאקולוגיה שלו. כיוון שהכפן הגושמני פעיל לילה, ואוכלוסיותיו מפוזרות לאורך החוף, קשה למדענים לקבל תמונה מלאה על האקולוגיה של מין חשוב זה. בגלל פערי המידע נעשתה לאחרונה פנייה לקהל הרחב הפעיל בחופי הים התיכון בישראל (איור 4) כדי לאסוף מידע (למשל על המועד והמיקום של הופעת נשלים וכפנים חיים) בשיטה של "מדע אזרחי" [2]. הקוראים מוזמנים גם הם להעביר מידע כזה לכותב המאמר ([email protected]).
איור 4
כרזה הקוראת לקהל הרחב הפעיל בחוף ובים לסייע באיסוף מידע על הכפן הגושמני, בהתאם לשיטת "מדע אזרחי"

- הלובסטר כפן גושמני הוא טורף הניזון בעיקר מצדפות. הוא מאוים על-ידי גורמים מקומיים, כגון דיג, וכנראה גם על-ידי תהליכים עולמיים כגון התחממות האוקיינוסים.
- מיעוט הידע על היבטים שונים בחיי מין זה, לצד קושי אובייקטיבי באיסוף המידע על הביולוגיה והאקולוגיה שלו, מקשים על מתן הגנה ראויה עליו.
- הדרך היעילה ביותר שנמצאה להגנה על הכפן הגושמני, הנחשב בישראל למין מוגן, היא באמצעות שמורות טבע ימיות.
מערכת אקולוגיה וסביבה
אלון רוטשילד, מנהל תחום המגוון הביולוגי, החברה להגנת הטבע:
המאמר חושף את מחזור החיים המרתק של הכפן הגושמני. הכפן עובר מהים הרדוד לעמודת המים של הים הפתוח, ממנה לקרקעית הים העמוק, ומשם בתנועה רגלית על קרקעית הים עד לשוניות הרדודות. זו דוגמה לצורך בניהול מרחבי אינטגרטיבי של הטבע הימי. מהצורך הזה ניתן לגזור מסקנות, התומכות במדיניות שמירת הטבע הנוכחית בישראל:
- יש לקדם שמורות טבע ימיות נרחבות, ללא דיג, המקיפות טווח עומקים נרחב ורציף מהמים הרדודים ועד לים העמוק.
- קידום שמורות טבע בתחום האזור הכלכלי הבלעדי בהתאם לתוכנית האב [1] צפוי לתמוך גם באוכלוסיית הכפן הגושמני, המבלה חלק ממחזור החיים שלו בעומק.
- מחוץ לשמורות ימיות חשוב לשמר את איכות בית הגידול ואת הקישוריות האקולוגית בין מרחבי הים המשמשים להגירת הכפנים:
- יש להשבית את דיג המכמורת על פני כל המרחב הימי של ישראל, כפי שכבר נעשה משנת 2016 בשליש הצפוני של המים הריבוניים (מצפון לחוף דור). רשת המכמורת חורשת את הקרקעית והיא בעלת פוטנציאל לקטוע את תנועת הכפנים ולפגוע בהם בהגירה מהעומק למים הרדודים וחזרה.
- יש להטמיע פרקטיקות מתקדמות להגנה על השלב הפלנקטוני, בהתבסס על מחקר, למשל מיתון השפעות סביבתיות של סקרים סיסמיים לחיפושי גז, שהוכחו כבר כפוגעים בפלנקטון בעמודת המים.
נוסף על כך, הציבור מוזמן להשתתף במדע למען הים, באמצעות דיווח על תצפיות ביישומון SeaWatch של החברה להגנת הטבע. דיווחים על מפגעים סביבתיים ותצפיות בבעלי חיים מועברים אוטומטית אל גורמי הטיפול והמחקר, בהתאם לסוג הדיווח. למשל, דיווח על תצפית בכפן גושמני נשלח ישירות אל קבוצת המחקר שבהובלת פרופ' אהוד שפניר, לצורך ניטור מצב האוכלוסייה בישראל.
מקורות
1. שבתאי ע, רוטשילד א, עמיר ד ואחרים. 2023. תכנית אב לשמורות טבע ימיות באזור הכלכלי הבלעדי בים התיכון
The Mediterranean Slipper Lobster – The known and the concealed in the ecology of a threatened species
Ehud Spanier, Department of Maritime Civilizations and The Leon Recanati Institute for Maritime Studies, University of Haifa (Israel)
The Mediterranean Slipper Lobster is the largest decapod crustacean on the Israeli Mediterranean coast and its wide geographical distribution includes the entire Mediterranean Sea and the east-central Atlantic Ocean. It is a protected natural value and a flagship species, yet it is threatened by overfishing, the destruction of the adults' habitat, and climate change. In the winter it stays in the submerged Kurkar sandstone ridges, where it shelters during the day in natural rocky dens and dark caves as an adaptation against diurnal predators such as the Mediterranean Triggerfish. Its nocturnal activity, its thick external armor, its camouflaged color, its ability to cling to the rocky substrate, and its quick escape swim in an emergency are among the additional adaptations of this lobster against predation. It feeds mainly on bivalves, which it gathers at night outside its den, opening their shells with its strong legs. The lobsters breed in the spring and the female lays tens of thousands of tiny eggs that she carries on her belly. From each egg hatches a leaf-like, transparent, tiny larva that lives and feeds in the open sea. This larva spends about a year offshore, going through several molts until it metamorphoses to a benthic form and sinks to the deep sea floor. As it grows, it gradually moves towards the shallower water where it finally joins the adult population. In the hot seasons, the adults migrate to deeper and colder waters where conditions are more suitable for the molting that allows their growth. There is limited knowledge about the chemical, mechanical, and visual senses, and almost nothing is known about the biology and ecology of the early life stages of this lobster. Marine nature reserves protected from fishing have proven to be the best means of conserving and recovering populations of the Mediterranean Slipper Lobsters. To properly protect a threatened species, it is necessary to have as much information about its biology and ecology as possible. An attempt is underway to mobilize the community of sea enthusiasts to provide information to scientists, through a “Citizen Science” project, about some of the questions that remain open regarding this important and beautiful marine species.
מקורות
- אלמוג-שטייר ג. 1988. היבטים אקולוגיים-התנהגותיים של לובסטרים מהים התיכון בעבר והכפן הגושמני, Scyllarides latus, בהווה (עבודה לקבלת תואר שני). חיפה: אוניברסיטת חיפה.
- סילבר ט, סילבר י וברעם-צברי א. 2021. שיתוף הציבור במחקר מדעי: קשת של אפשרויות. אקולוגיה וסביבה 12(4).
- Barshaw DE, Lavalli KL, and Spanier E. 2003. Offense versus defense: Responses of three different morphological types of lobsters to predation. Marine Ecology Progress Series 256: 171–182.
- Barshaw DE and Spanier E. 1994. Anti-predator behaviors of the Mediterranean slipper lobster Scyllarides latus. Bulletin of Marine Science 55 (2–3): 375–382.
- Bianchini ML, Bono G, and Ragonese S. 2001. Long-term recaptures and growth of slipper lobsters, Scyllarides latus, in the Strait of Sicily (Mediterranean Sea). Crustaceana 74(7): 673–680.
- Bianchini ML, Spanier E, and Ragonese S. 2003. Enzymatic variability of Mediterranean slipper lobsters, Scyllaides latus, from Sicilian waters. Series Historia Naturalis 13(1): 43–50.
- Boles L and Lohmann K. 2003. True navigation and magnetic maps in spiny lobsters. Nature 421: 60–63.
- Butler M, MacDiarmid A, and Cockcroft A. 2011. Mediterranean slipper lobster. The IUCN Red List of Threatened Species 2011: 169983A6698918.
- Díaz D, Hereu B, Aspillaga E, et al. 2020. Movimiento y uso del hábitat en la cigarra de mar (Scyllarides latus): Implicaciones para la conservación de la especie en el parque nacional marítimo terrestre del Archipiélago de Cabrera (scytrack). Centro Oceanográfico de Baleares.
- Faria J, Froufe E, Tuya F, et al. 2013. Panmixia in the endangered slipper lobster Scyllarides latus from the Northeastern Atlantic and Western Mediterranean. Journal of Crustacean Biology 33(4): 557–566.
- Goldstein JS and Spanier E. 2023. Increasing seawater temperatures in the Levantine basin, eastern Mediterranean may elicit increased activity in slipper lobsters, Scyllarides latus (Latreille, 1803) (Decapoda: Achelata: Scyllaridae). Journal of Crustacean Biology 42(4): ruac061.
- Holthuis LB. 1991. Marine lobsters of the world. FAO Fisheries Synopsis 13(125).
- Lau STF, Spanier E, and Meyer-Rochow VB. 2009. Anatomy and ultrastructural organisation of the eye of the Mediterranean slipper lobster, Scyllarides latus: preliminary results. New Zealand Journal of Marine and Freshwater Research 43(1): 233–245.
- Lavalli KL and Spanier E. 2001. Does gregariousness function as an antipredator mechanism in the Mediterranean slipper lobster, Scyllarides latus? Marine and Freshwater Research 52(8): 1133–1143.
- Lavalli KL and Spanier E. 2010. Infraorder Palinura Latreille, 1802. In: Forest J and von Vaupel Klein JC (Eds). The Crustacea, Traite de Zoologie 9A – Decapoda. Leiden, Boston: Koninklijke Brill.
- Lavalli KL and Spanier E. 2015. Predator adaptations in Decapods. In: Thiel M and Watling L (Eds). The Natural History of the Crustacea, Vol. 2: Lifestyles and Feeding Biology. NY: Oxford University Press.
- Lavalli KL, Spanier E, and Goldstein JS. 2019. Scyllarid lobster biology and ecology. In: Diarte-Plata G and Escamilla-Montes R (Eds). Crustacea. London: IntechOpen.
- Lavalli KL, Spanier E, and Grasso F. 2007. Behavior and sensory biology of slipper lobsters. In: Lavalli KL and Spanier E (Eds). The Biology and Fisheries of the Slipper Lobsters. Boca Raton (Fl): CRC Press.
- Martins HR. 1985a. Biological studies on the exploited stock of the Mediterranean locust lobster, Scyllarides latus, (Latrielle, 1803) (Decapoda, Scyllaridae) in the Azores. Journal of Crustacean Biology 5: 294–305.
- Martins HR. 1985b. Some observations on the naupliosoma and phyllosoma larvae of the Mediterranean locust lobster, Scyllarides latus, (Latrielle, 1803) from the Azores. Intl. Council for the Exploration of the Sea C.M.K. 52 Shellfish Committee. 13 p.
- Miller E, Spanier E, Diamant R, and Yahel R., 2023. Nature reserves facilitate the conservation of the Mediterranean slipper lobster, Scyllarides latus. Marine Ecology Progress Series 714: 57–69.
- Pessani D and Mura M. 2007. The biology of the Mediterranean Scyllarids. In: Lavalli KL and Spanier E (Eds). The Biology and Fisheries of the Slipper Lobsters. Boca Raton (Fl): CRC Press.
- Reñones O, Coll J, Díaz D, et al. 2009. Estudio de la biología y ecología de Scyllarides latus en el Parque Nacional Marítimo Terrestre del Archipiélago de Cabrera. Implicaciones para la gestión de la especie en las Islas Baleares. Report number: LATUS 2006-2009. COB-IEO.
- Sekiguchi H, Booth D, and Webber WR. 2007. Early life histories of Slipper Lobsters. In: Lavalli KL and Spanier E (Eds). The Biology and Fisheries of the Slipper Lobsters. Boca Raton (Fl): CRC Press.
- Spanier E. 1987. Mollusca as food for the slipper lobster Scyllarides latus in the coastal waters of Israel. Levantina 68: 713–716.
- Spanier E and Almog-Shtayer G. 1992. Shelter preferences in the Mediterranean slipper lobster: Effects of physical properties. Journal of Experimental Marine Biology and Ecology 164(1): 103–116.
- Spanier E and Lavalli KL. 1998. Natural history of Scyllarides latus (Crustacea Decapoda): A review of the contemporary biological knowledge of the Mediterranean slipper lobster. Journal of Natural History 32(10–11): 1769–1786.
- Spanier E and Lavalli KL. 2007. Slipper lobster fisheries – Present status and future perspectives. In: Lavalli KL and Spanier E (Eds). The Biology and Fisheries of the Slipper Lobsters. Boca Raton (Fl): CRC Press.
- Spanier E and Lavalli KL 2013a. Commercial Scyllarids. In: Phillips BF (Ed). Lobsters: Biology, management, aquaculture and fisheries. Oxford (UK): Blackwell.
- Spanier E and Lavalli KL. 2013b. First record of an early benthic juvenile likely to be that of the Mediterranean slipper lobster, Scyllarides latus (Latreille, 1802). Crustaceana 86(3): 259–267.
- Spanier E, Lavalli KL, and Edelist D. 2011. Chapter 6: Artificial reefs for lobsters – An overview of their application for fisheries enhancement, management, and conservation. In: Bortone S, Brandini FP, Fabi G, and Otake S (Eds). Artificial Reefs in Fisheries Management. NY: CRC Press (Taylor & Francis Group).
- Spanier E, Miller E, and Zviely D. 2017. Winter stranding of Mediterranean slipper lobsters, Scyllarides latus. Regional Studies in Marine Science 14: 126–131.
- Spanier E, Tom M, Pisanty S, and Almog G. 1988. Seasonality and shelter selection by the slipper lobster Scyllarides latus in the southeastern Mediterranean. Marine Ecology Progress Series 42: 247–255.
- Spanier E, Weihs D, and Almog-Shtayer G. 1991. Swimming of the Mediterranean Slipper lobster. Journal of Experimental Marine Biology and Ecology 145(1): 15–31.
- Spanier E and Zviely D. 2022. Key environmental impacts along the Mediterranean coast of Israel in the last 100 years. Journal of Marine Science and Engineering 11(1): 2.
- Spanò S, Ragonese S, and Bianchini M. 2003. An anomalous specimen of Scyllarides latus (Decapoda, Scyllaridae). Crustaceana 76(7): 885–889.
- Steger J, Bošnjak M, Belmaker J, et al. 2022. Non‐indigenous molluscs in the Eastern Mediterranean have distinct traits and cannot replace historic ecosystem functioning. Global Ecology and Biogeography 31(1): 89–102.
- Tarsitano SF, Lavalli KL, Horne F, and Spanier E. 2006. The constructional properties of the exoskeleton of Homarid, Palinurid, and Scyllarid Lobsters. Hydrobiologia 557(1): 9–20.
- Weisbaum D and Lavalli KL. 2004. Morphology and distribution of antennular setae of scyllarid lobsters (Scyllarides aequinoctialis, S. latus, and S. nodifer) with comments on their possible function. Invertebrate Biology 123(4): 324–342.
קריאה נוספת
מאמר העוסק בביולוגיה ובאקולוגיה של כפנים, כולל של הכפן הגושמני.
Lavalli KL, Spanier E, and Goldstein JS. 2019. Scyllarid lobster biology and ecology. In: Diarte-Plata G and Escamilla-Montes R (Eds). Crustacea. London: IntechOpen.
מאמר העוסק בהשפעות סביבתיות על החופים הים תיכוניים של ישראל, שחלק מהן משפיעות על שגשוגו של הכפן הגושמני.
Spanier E and Zviely D. 2022. Key environmental impacts along the Mediterranean coast of Israel in the last 100 years. Journal of Marine Science and Engineering 11(1): 2.
מאמר העוסק ב"מדע אזרחי" וכיצד הוא עשוי לסייע למדענים ולמדע.
סילבר ט, סילבר י וברעם-צברי א. 2021. שיתוף הציבור במחקר מדעי: קשת של אפשרויות. אקולוגיה וסביבה 12(4).